| Identificatie van g-proteďne gekoppelde receptoren met een mogelijke rol in suikersensing in darmepitheelcellen. (Stijn De Graeve) |
| home | lijst scripties | inhoud | vorige | volgende |
Het Laboratorium voor Moleculaire Celbiologie is leider in het onderzoek naar signaalwegen voor de detectie van nutriënten in gist. Met het Gpr1-Gpa2 systeem hebben ze het eerste nutriënt geactiveerde GPCR systeem ontdekt in eukaryote cellen. Gpr1 is een G-proteďne gekoppelde receptor voor glucose en is aan Gpa2 gekoppeld, een G-proteďne dat bij activatie een cAMP signaal veroorzaakt. Doordat er aanwijzingen zijn dat zoogdieren ook over een GPCR voor glucose beschikken is men recent gestart met het onderzoek naar glucose-sensing mechanismen in zoogdiercellen.
Aan de Universiteit van Liverpool werd aangetoond dat epitheelcellen van de darm van het schaap en de muis de aanwezigheid van glucose detecteren zonder het glucose te transporteren, met een verhoging van het aantal SGLT1 Na+/glucose cotransporters in het borstelzoommembraan tot gevolg. Hetzelfde effect werd waargenomen bij toedienen van de PKA-agonist 8-Br-cAMP. Dit zijn aanwijzingen dat er ook in het darmepitheel van zoogdieren een GPCR is voor glucose die aan een Gα-proteďne gekoppeld is. De laatste jaren zijn dankzij de publicatie van het muisgenoom honderden GPCR’s ontdekt waarvan het ligand niet gekend is, de zogenaamde weesreceptoren of ‘orphan GPCR’s’. De kans is groot dat de receptor voor glucose van de muis één van deze weesreceptoren is.
De eerste stap in het onderzoek naar de glucosereceptor in het epitheel van de dunne darm is de bepaling van welke GPCR’s tot expressie komen in de darmepitheelcellen. In dit onderzoek worden PCR-gebaseerde technieken aangewend om de aanwezigheid van GPCR-mRNA’s aan te tonen in RNA extracten van muizendarmepitheelcellen en van STC-1 cellen, een entero-endocriene cellijn die als modelsysteem geldt voor het darmepitheel. Dit toont enkel aan welke receptorgenen tot transcriptie komen maar zegt niets over de activiteit of de localisatie van het genproduct.
Na dit onderzoek zal functionele screening uitgevoerd worden op de genen waarvan we de expressie in de darmepitheel hebben aangetoond. Enerzijds kan nagegaan worden of overexpressie van het receptorgen het groeidefect kan opheffen in de gpr1D sch9D suiker-sensing deficiënte giststam, Gpa2 zal hiervoor vervangen worden door een chimeer Gα16-Gpa2 proteďne. Anderzijds zal met SiRNA in de STC-1 cellijn de expressie van de aangetoonde receptors uitgeschakeld worden, waarna kan nagegaan worden of dit de stijging van het aantal SGLT1 transporters teniet doet bij toevoegen van glucose.
In dit thesisonderzoek worden de eerste stappen gezet voor een onderzoek naar de glucose-geactiveerde GPCR in de darmwand van zoogdieren. Het aantonen van een GPCR voor glucose in de darm zal niet alleen een nieuw wapenfeit zijn voor een laboratorium met een missie in ‘nutrient-sensing’, het zal ook een belangrijke ontdekking zijn voor de gastro-enterologie en de hele medische wetenschap.
1. Signalering via G-proteďne gekoppelde receptoren
1.1. G-proteďne gekoppelde receptoren.
De evolutie van meercellige organismen is sterk afhankelijk geweest van de capaciteit van hun cellen om signalen van elkaar en de omgeving te ontvangen, door middel van receptoren voor signaalmoleculen. Er zijn slechts vier families van membraangebonden receptoren die intracellulaire boodschappermoleculen en zintuiglijke signalen herkennen. De grootste familie is die van de G-proteďne gekoppelde receptoren (GPCR’s). GPCR’s behoren tot de oudste systemen voor signaaltransductie en komen voor in planten, gist, slijmzwammen, protozoa en de vroegste diblastische metazoa. (Vernier et al., 1995) GPCR’s komen tussen in de herkenning en transductie van een enorme diversiteit aan signalen: licht, calciumionen, geurstoffen en feromonen, aminozuren, hormonen, chemokines en ook nutriënten. Hun intracellulair domein interageert met heterotrimere guanine nucleotide bindende proteďnen (G-proteďnen). Bij activatie van de receptor komt het G-proteďne vrij en activeert of deactiveert een effector die een intracellulair signaal veroorzaakt.
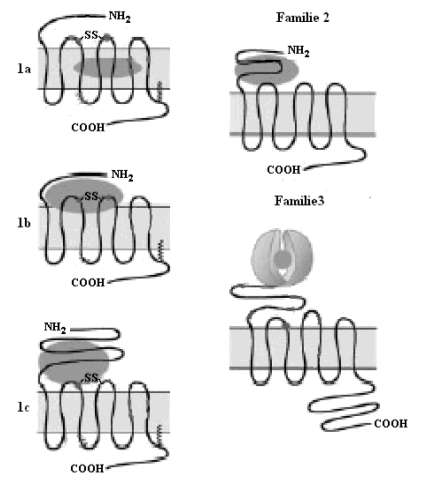
GPCR’s hebben gemeen dat ze zeven transmembraan-α-helices (TM’s) van 20 tot 25 aminozuren bevatten, verbonden door drie extracellulaire (e1, e2 en e3) en drie intracellulaire lussen (i1, i2 en i3). Aan de N-terminus van alle tot nu toe gekende GPCR’s bevindt zich minstens één consensussequentie voor N-gekoppelde glycosylatie. De hoogste graad van homologie tussen verschillende GPCR’s vindt men terug in de aminozuursequentie van de TM’s. TM’s bestaan voornamelijk uit hydrofobe aminozuren, TM’s 1, 4 en 7 zijn meer hydrofoob dan TM’s 2, 3, 5 en 6. De transmembraanhelices zijn in tegenwijzerzin georiënteerd, gezien vanuit extracellulair standpunt (Unger et al., 1997). De GPCR’s verschillen in de lengte en functie van het N-terminale extracellulaire domein, het C-terminale cytoplasmatische domein, de extracellulaire en de intracellulaire lussen
Op basis van sequentiehomologie kan men de GPCR’s in drie grote families onderbrengen. Familie één is de grootste familie, en bevat receptoren voor retinal (rhodopsine), angiotensine en geurstoffen en adrenerge receptoren, receptoren voor kleine peptiden en receptoren voor glycoproteďnehormonen. Familie één wordt in drie categorieën opgedeeld: 1a, 1b en 1c. Een aantal geconserveerde cysteďneresidu’s spelen een rol in de structuur van de receptoren van familie één. Twee cysteďnes in e1 en e2 vormen een disulfidebrug, die een beperkt aantal conformaties van de 7 TM’s stabiliseert. Een cysteďneresidu is terug te vinden in de C-terminus van veel GPCR’s van familie 1 en is in vele gevallen gepalmytoyleerd. Deze palmitylgroep zou de C-terminus stabiliseren door hem in het plasmamembraan te verankeren. Leden van de 1a-subfamilie zoals rhodopsine en de adrenerge receptoren binden het ligand in een polaire holte tussen de TM’s. De 1b-subfamilie bestaat uit GPCR’s die door kleine peptiden (bijvoorbeeld cytokines, thrombine) worden geactiveerd. Hier bindt het ligand ter hoogte van de N-terminus en de extracellulaire lussen. Subfamilie 1c bestaat uit receptoren voor glycoproteďnehormonen. Een lange N-terminale staart komt samen met e1 en e3 tussen in ligandbinding en receptoractivatie. GPCR’s van familie twee worden geactiveerd door grote peptiden, bijvoorbeeld secretine, glucagon en VIP. Kenmerkend is het grote N-terminale domein. Familie drie bevat de metabotrope glutamaatreceptors en receptors voor feromonen en GABA. Deze receptors bestaan uit een zogenaamde dubbele structuur. Het N-terminale extracellulaire domein vertoont sequentiegelijkenissen met de periplasmatische bindingsproteďnen van bacteriën, die een rol spelen in het transport van aminozuren, ionen of suikers. De ligand-gebonden vorm van het extracellulaire domein activeert dan het 7 TM gebied van de receptor. De feromoonreceptoren in gist zijn GPCR’s die geen gelijkenis vertonen met één van deze drie grote families en worden bijgevolg in een kleine vierde familie geplaatst. (Bockaert en Pin, 1999)
Er bestaat dus een verband tussen de grootte van de liganden die een GPCR kunnen activeren, en de sequentie van de bindende receptoren. Verschillende delen van de receptor kunnen betrokken zijn in de binding van ligand. Bij interacties tussen liganden en receptoren blijken altijd waterstofbindingen, ionenparen en hydrofobe contacten een rol te spelen.
Tussen receptoren van verschillende families is er weinig gelijkenis in aminozuursequentie, men vermoedde dat de GPCR superfamilie door moleculaire convergentie is ontstaan. Door de toename van het aantal gekende GPCR genen in de laatste jaren en de ontwikkeling van sterke informatietechnologie is de hoeveelheid beschikbare informatie sterk toegenomen. Graul en Sadée (2001) combineren verschillende alignerings-strategieën om in een databank van nucleotide- en aminozuur sequenties van GPCR’s naar evolutionaire verwantschappen te zoeken. Zij concluderen dat de GPCR superfamilies wel met elkaar verwant zijn en stellen een cladogram op waarbij de GPCR’s van gist GPR1 en STE2 verre verwanten zijn van familie drie en STE3 een verre verwant van familie één.

Fig.1: Families van GPCR’s (Bockaert en Pin, 1999)
Doordat men van membraanproteďnen zeer moeilijk kristallen kan maken die geschikt zijn voor X-stralen chromatografie, is er over de tertiaire structuur van GPCR’s nog maar weinig informatie beschikbaar. Biochemische, farmacologische en genetische technieken worden gecombineerd met biofysische analyses om belangrijke elementen in het signaleringsmechanisme van GPCR’s te identificeren. Bacteriorhodopsine is geen GPCR, maar eerder een protonpomp. Het is wel structureel verwant met de familie van de GPCR’s. De structuur die door electronendifractie van een tweedimensioneel bacteriorhodopsinechristal gekend is, staat model voor de tertiaire structuur van heel wat GPCR’s. Driedimensionele modellen van GPCR’s kunnen verfijnd worden wanneer meer experimentele gegevens uit bijvoorbeeld mutagenesestudies beschikbaar komen.
Studies op de ‘lichtreceptor’ rhodopsine tonen aan dat de verandering in onderlinge oriëntatie van TM 3, TM 5 en TM 6 essentieel is voor de activatie van het G-proteďne in het ternair complex (Farrens et al., 1996).
Activatie van een GPCR leidt niet enkel tot activering van een signaalweg, maar ook tot desensitisatie van de receptor. Lange termijn desensitisatie wordt gekenmerkt door een afname van receptoren in de uren na activatie. Om het aantal receptoren terug op peil te brengen is de novo proteďnesynthese nodig. Korte-termijn desensitisatie veroorzaakt een snelle stopzetting van de signalering. Resensitisatie kan hier snel optreden zonder de novo proteďnesynthese. Homologe desensitisatie leidt tot een verminderde respons op het specifieke ligand. De GPCR wordt gefosforyleerd door G-proteďne receptor kinasen (GRK), dit is strikt afhankelijk van de activatie van de receptor door hoge concentraties van zijn specifieke ligand. (Walker et al., 2004) Heterologe desensitisatie vermindert de respons op elke stimulus die PKA of PKC activeert. (Tobin, 1997)
1.2. G-proteďnen
Guanine-nucleotide-bindende proteďnen spelen een belangrijke rol in het doorgeven van extracellulaire signalen aan de cel. Ze vormen een soort aan-uit schakelaar voor cellulaire processen, die van buitenaf gereguleerd worden. Ze zijn actief in de GTP-gebonden toestand en inactief wanneer GDP gebonden is. Er zijn twee soorten G-proteďnen die signaaltransductie mediëren: heterotrimere G-proteďnen en kleine GTPasen, waarvan de Ras proteďnen de belangrijkste zijn.
1.2.1. Heterotrimere G-proteďnen
Heterotrimere G-proteďnen bestaan uit een α-, β- en γ-subeenheid. Het ternair-complex-model (ligand, GPCR en G-proteďne in één complex) is het meest aanvaarde model voor GPCR/G-proteďne systemen. Het inactieve G-proteďne is in de heterotrimere vorm gebonden aan de receptor. De Gα-subeenheid heeft GDP gebonden. Bij binding van het ligand aan de GPCR wordt GDP losgelaten en GTP gebonden. De Gα-subeenheid laat los van de Gβ/Gγ-subeenheden en van de receptor. Nu kan zowel GTP-gebonden Gα als het vrije Gβγ-complex het signaal overbrengen naar een effectormolecule. Eén ligand-receptor complex kan meerdere G-proteďnen activeren. Voorbeelden van effectormoleculen zijn adenylaat cyclase, fosfolipasen C en A2 en transmembraankanalen voor K+, Na+ en Ca2+. Deze effectors amplificeren het signaal nog meer door de vorming van grote hoeveelheden secundaire boodschappers (cAMP, cGMP, IP3, K+, Na+ en Ca2). Het Gα-proteďne heeft een intrinsieke GTPase activiteit en veroorzaakt zijn eigen desactivatie door hydrolyse van GTP tot GDP. Het Gα proteďne bindt terug met het Gβγ-complex en het heterotrimere G-proteďne kan terug door een geladen GPCR geactiveerd worden. De Gβ- en Gγ-subeenheden komen in normale omstandigheden niet van elkaar los. Zij vormen samen het Gβγ-complex dat de interactie van de Gα-subeenheid en de receptor stabiliseert, maar ook een effector kan activeren als Gα ervan gedissocieerd is.
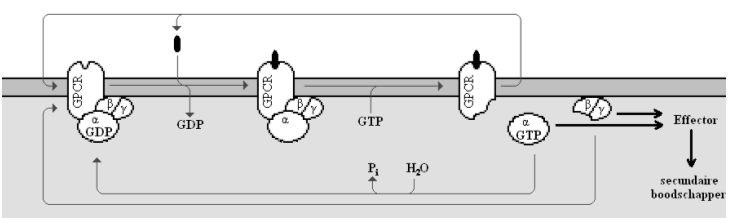
Fig 2. De activering van heterotrimere G-proteďnen door GPCR’s
Heterotrimere G-proteďnen worden in klassen verdeeld naargelang het soort Gα-subeenheid. Op basis van sequentiegelijkenissen werden de Gα-proteďnen in vier families onderverdeeld; nl.: Gs, Gi, Gq en Go. Elk van deze klassen heeft zijn eigen signaalweg, met een specifiek effect op de concentraties van intracellaire boodschappermolecules en de werking van enzymes.
GTP-gebonden Gαs-subeenheden activeren adenylaat cyclase, dat ATP omzet in 3’5’ cyclisch AMP (cAMP). cAMP activeert het cAMP-afhankelijke proteďne kinase (PKA) door binding aan de regulatorische subeenheden. PKA verbindt het cAMP signaal met verschillende systemen, zoals ion kanalen, transcriptiefactoren en metabolische enzymen. Cholera toxine zorgt door ADP-ribosylatie van G-proteďnen dat ze in de geactiveerde GTP-gebonden toestand blijven.
Gαi- en Gαo-proteďnen inhiberen adenylaat cyclase door eraan te binden maar het niet te activeren. Zij werken dus antagonistisch aan Gs-proteďnen. Ook het Gβγ-complex van deze G-proteďnen kan interageren met effectormoleculen zoals K+-kanalen, fosfolipase C (PLC) en inositol-3-fosfaat kinase (IP3K). Pertussis toxine hecht een ADP-ribosyl-groep aan het COOH uiteinde van deze G-proteďnen waardoor deze niet meer door een receptor kunnen geactiveerd worden.
De Gq-signaalweg stimuleert PLC om de secundaire boodschappers inositol-trisfosfaat (IP3) en diacylglycerol (DAG) te vormen door fosforolyse van een fosfodiëster. IP3 stimuleert de vrijzetting van Ca2+ uit intracellulaire opslagplaatsen en DAG recruteert het Ca2+-afhankelijke proteďne kinase (PKC) naar het membraan en activeert het. Het vrijgestelde Ca2+ induceert een verdere stijging door activatie van Ca2+-kanalen in het plasmamembraan, tot een bepaald niveau, waarbij het Ca2+ snel terug weggepompt wordt. De activatie van de Gq-signaalweg resulteert dus in een verhoogde frequentie in de oscillaties van de Ca2+-concentratie, eerder dan in permanente accumulatie van Ca2+ (Berridge, 1991)
1.2.2. Kleine GTPasen: Ras proteďnen
Ras proteďnen zijn GTPasen met een lage molecuulmassa, die sterk geconserveerd zijn in eukaryote organismen. Ze maken deel uit van de Ras superfamilie van GTPasen, die nog twee andere grote families bevat: Rho/Rac proteďnen die betrokken zijn in de organisatie van het cytoskelet, en Rab proteďnen die het transport van vesikels tussen verschillende intracellulaire compartimenten reguleren.
De Guanine nucleotide uitwisselingsfactor (GEF) speelt hier de rol van geactiveerde GPCR, GEF bindt aan het Ras proteďne waardoor GDP dissocieert. Hierna bindt GTP spontaan aan het Ras proteďne waardoor GEF dissocieert. In tegenstelling tot de Gα-subeenheid van heterotrimere G-proteďnen kunnen Ras proteďnen zelf maar zwak GTP hydrolyseren. De deactivatie van Ras gebeurt door de binding van een GTPase activerend proteďne (GAP) en hydrolyse van het GTP, waarbij fosfaat en GAP dissociëren van het het Ras proteďne. GEF’s en GAP’s zijn dus respectievelijk activator en inhibitor van Ras signalering, die ook in andere families van de Ras superfamilie voorkomen. (Bugoski en McCormick, 1993)
2. Glucose-sensing
Glucose is de primaire brandstof voor de meeste cellen. Het is de koolstofbron voor de glycolyse, de glycogeensynthese en de pentosefosfaatweg. Omdat de hoeveelheid beschikbare glucose sterk kan veranderen moet de cel over een sensorsysteem en signaalwegen beschikken die het metabolisme eraan aanpassen. De respons is afhankelijk van het soort cel. Glucose-sensing omvat de mechanismen waarop een cel de beschikbaarheid van glucose in zijn omgeving detecteert, en deze informatie doorgeeft aan cellulaire regulatieproteďnen.
Glucose is dus naast nutriënt ook boodschappermolecule voor cellen. De laatste jaren is de interesse voor glucose-sensing mechanismen sterk toegenomen, waardoor belangrijke kennis over de meest uiteenlopende organismen is verworven. Bij gist werden proteďnen met een directe rol in glucose-signalering ontdekt. In planten vindt men ook een diversiteit aan glucose-geďnduceerde signalen en in zoogdieren constateert men dat glucose-sensing een onmisbaar instrument is, dat door een grote verscheidenheid aan signaaltransductiewegen wordt gemedieerd in een groot aantal uiteenlopende cellen, weefsels en organen.
2.1. Mogelijke glucose-sensing mechanismen in eukaryote cellen.
Omdat glucose naast boodschappermolecule in de eerste plaats een nutriënt is voor de cel, zijn er veel meer mogelijke manieren waarop de aanwezigheid ervan kan gedecteerd worden dan het geval is voor klassieke boodschappers, zoals hormonen.
Glucose kan gedetecteerd worden door specifieke glucose-receptoren in het plasmamembraan ofwel op basis van zijn transport en metabolisme. In het eerste geval kan de receptor een niet-transporterende glucosecarrier-homoloog (Fig.3 c) zijn, die tot een glucosesensor is geëvolueerd. Anderzijds kan de receptor ook behoren tot een gekende familie van ligand-bindende receptoren die structureel niet verwant is met een glucosecarrier. Bijvoorbeeld een GPCR met een specifieke bindingsplaats voor glucose (Fig.3 a).
Als het glucose-sensing mechanisme gekoppeld is aan het metabolisme, kan het uitgevoerd worden door een actieve glucosecarrier (Fig.3 b) of door een metabolisme-afgeleid signaal. In het eerste geval activeert de transporterende carrier het volgende proteďne in de signaalweg. In het tweede geval kunnen glucose-6-fosfaat, en andere metabolieten van glucose, dienen als ‘metabolische boodschapper’. Dit soort indirecte signalering veroorzaakt een eerder onspecifiek signaal: het beďnvloedt verschillende signaalwegen en doelwitten.
Een actief glucose fosforylerend enzym (Fig.3 e) kan dan de signalerende component zijn doordat het in de katalytisch actieve conformatie interageert met stroomafwaartse componenten in de signaalweg. Homologen van glucose fosforylerende enzymen met een zwakke of geen katalytische functie (Fig.3 d) kunnen ook een signaal genereren, zoals bij niet-transporterende glucosecarrier-homologen. Eindproducten van het glucose-metabolisme, zoals ATP en reducerend vermogen, kunnen ook dienen als signaal. (Fig.3 f) Bovendien kunnen twee of meer mechanismen samen een effect veroorzaken. (Rolland et al., 2002)
Dat pas recent het eerste nutriënt-geactiveerde GPCR-systeem werd ontdekt (Kraakman et al., 1999) is te wijten aan de uitgebreide alternatieve mogelijkheden voor detectie van nutriënten, zowel binnenin de cel als ter hoogte van het membraan, uitgaande van de gekende enzymen die met het nutriënt of zijn producten in contact komen.
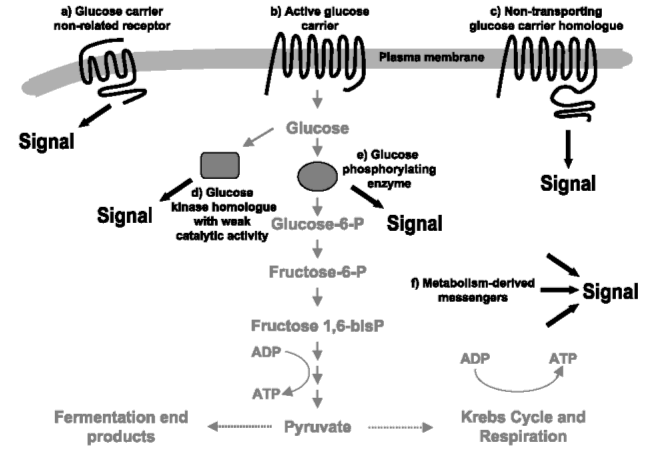
Fig.3 Mogelijke mechanismen voor detectie van glucose in eukaryote cellen (Rolland et al., 2002)
2.2. Experimentele benaderingen
Een belangrijke vraag bij het onderzoeken van de signaalwegen is of de regulerende functie kan losgekoppeld worden van de nutriënt-functie. Daarom wordt in de eerste plaats nagegaan of het regulerende effect ook kan worden teweeggebracht door niet of slechts gedeeltelijk metaboliseerbare analoge substraten. Als 6-deoxyglucose en 3-O-methylglucose (glucose-analoge substraten die worden getransporteerd maar niet verder gemetaboliseerd) het regulerende effect van glucose induceren, kan men besluiten dat signalering gebeurt ter hoogte van het glucosetransport. Als 2-deoxyglucose (een analoog dat getransporteerd en gefosforyleerd wordt, maar niet verder gemetaboliseerd) het effect induceert, gebeurt signalering waarschijnlijk door het enzyme dat glucose fosforyleert. Als L-glucose (het niet transporteerbare enantiomeer van het veel meer voorkomende D-glucose) de signaalweg activeert, kan men aannemen dat signalering gebeurt door een receptor op het celoppervlak. Ook studies met mutante cellijnen, die beschikken over een deficiënt glucosemetabolisme en studies met specifieke inhibitoren (bijvoorbeeld: de hexokinase inhibitor manoheptulose) zijn nuttig geweest. Een probleem met deze methoden is echter dat ze een snelle uitputting van het ATP veroorzaken, in tegenstelling tot het normale effect van glucose.
Door electroporatie van plantenprotoplasten en de introductie van hexosefosfaten (waarvoor het celmembraan normaal impermeabel is) kan men de signaleringsrol van een actief hexokinase omzeilen (Jang en Sheen, 1994). Regulerende domeinen van proteďnen die zowel voor glucosemetabolisme als voor glucosesensing nodig zijn, kunnen geďdentificeerd worden door screening van mutanten of door expressie van homologe proteďnen uit andere organismen. Hoe meer metabolisatie (voorbij transport en fosforylatie) vereist is voor de regulerende effecten van glucose, hoe moeilijker het is om de signaalweg bloot te leggen. Een mogelijke benadering is het gebruik van alternatieve substraten die hetzelfde product genereren. Zo kon men aantonen dat stoffen die het ATP niveau doen stijgen, insulinesecretie stimuleren in β-cellen van de pancreas, wat aangeeft dat ATP hier een ‘metabolische boodschapper’ is. (Schuit et al., 2001)
3. Glucose-sensing in Saccharomyces cerevisiae.
3.1. Gist en glucose: stationaire fase, respiratie en fermentatie.
Eencellige, vrijlevende organismen, zoals gist, zijn over het algemeen zeer goed aangepast aan constant veranderende omgevingen. Ze hebben mechanismen ontwikkeld om op extreme variaties in de nutriëntbeschikbaarheid te reageren, meer bepaald door hun groei en metabolisme eraan aan te passen. De beslissing om te proberen groeien bij nutriëntlimitatie zou nefast zijn voor de overleving van micro-organismen.
Het meest dramatische effect is waarneembaar bij uithongering of ‘nutrient starvation’. Micro-organismen kunnen lange perioden overleven in afwezigheid van één of meer nutriënten door het stilleggen van de celcyclus in combinatie met een aantal fysiologische veranderingen; de cel gaat in ‘stationaire fase’. Gistcellen in stationaire fase worden gekenmerkt door hun hittebestendigheid en hun weerstandigheid aan andere stressfactoren. Ze accumuleren hoge concentraties aan de reservestoffen glycogeen en trehalose. Hoewel gist normaal een eencellige schimmel is kan nutriëntlimitatie, bijvoorbeeld stikstof-deprivatie, een drastische morfogenetische switch veroorzaken, die resulteert in de vorming van pseudohyfen. Deze filamenteuze draden stellen het organisme in staat actief op zoek te gaan naar stikstofbronnen. (Gagiano et al., 2002)
In aanwezigheid van zuurstof zijn gistcellen in staat ATP te genereren uit niet-fermenteerbare koolstofbronnen (bijvoorbeeld glycerol, lactaat, ethanol) door oxidatieve fosforylatie in de mitochondriën. Respirerende cellen groeien veel trager dan fermenterende cellen en vertonen nog andere kenmerken van de stationaire-fase-cellen zoals hoge expressie van genen betrokken bij stressresistentie en accumulatie van reservekoolhydraten.
Glucose-gevoelige gistspecies zoals Saccharomyces cerevisiae en in mindere mate Schizosaccharomyces pombe verkiezen fermentatie boven respiratie, ook in aanwezigheid van zuurstof. De enzymen die noodzakelijk zijn voor respiratie, gluconeogenese en metabolisatie van alternatieve suikers worden niet gesynthetiseerd in aanwezigheid van glucose. Respiratie levert meer ATP op per mol suiker dan alcoholische fermentatie. Alcoholische fermentatie verloopt echter sneller dan respiratie en het gevormde ethanol kan nog worden gerespireerd als het glucose is opgebruikt. Het belangrijkste voordeel evenwil is dat ethanol de groei van concurrerende micro-organismen inhibeert, vermits gistcellen zeer ethanol-resistent zijn. (Pronk, 2000) Additie van snel fermenteerbare suikers aan respirerende gistcellen of gistcellen in stationaire fase veroorzaakt een aantal regulerende effecten. Deze dienen om het exclusieve en optimale gebruik van de fermenteerbare bron te verzekeren. Het glucosetransport en de glycolyse worden geactiveerd, terwijl gluconeogenese en de genen voor respiratie en metabolisme van alternatieve koolstofbronnen worden geďnhibeerd. Er is een sterke stijging van de groeisnelheid, voorafgegaan door een verhoogde transcriptie en translatie. De gistcellen worden gevoeliger aan stress (hitte, bevriezing, hoge osmolariteit,…) en trehalose wordt afgebroken. (Rolland et al., 2002)
3.2. Glucose-sensing mechanismen in S. cerevisiae
Gistcellen gebruiken zowel positieve als negatieve controlemechanismen om te reageren op de beschikbaarheid van glucose in het medium. Enzymconcentraties worden gereguleerd door repressie en inductie van de transcriptie van genen, stabiliteit van het mRNA en stabiliteit van het eiwit. De activiteit van enzymen wordt post-transcriptioneel gereguleerd door allosterische en covalente activatie en inhibitie. De signaalwegen die verantwoordelijk zijn voor de fenotypische effecten van glucosesignalering zijn glucose-repressie, glucose-inductie en de Ras-cAMP signaalweg
De dramatische effecten van glucose op gistcellen zijn een aanwijzing dat glucose-sensing via een directe signalering verloopt, met een receptor in het plasmamembraan. Omdat glucose echter ook opgenomen en afgebroken wordt in S. cerevisae, zijn er ook aanknopingspunten voor indirecte signalering. Hoewel de cel dus ook de activiteit van een bestaande metabolische component of de aanwezigheid van een of meer catabolieten kan gebruiken voor de detectie van glucose (en van de afbraak ervan), heeft het gebrek aan specificiteit van dergelijk systeem de ontwikkeling van specifieke sensoren gestimuleerd.
Het is bewezen dat gist verschillende sensing-mechanismen combineert om de groei en metabolische activiteit precies aan te passen aan de hoeveelheid en kwaliteit van de beschikbare suikers. De inductie van glycolytische enzymen door glucose is afhankelijk van de accumulatie van intermediaire metabolieten, hexose-6-fosfaten of glycolytische metabolieten met drie koolstofatomen. De meeste glucose-geďnduceerde effecten in gist vereisen meestal slechts gedeeltelijke metabolisatie. De meeste signaalwegen zijn onafhankelijk van de stappen in de glycolyse die na de suiker-kinase stap komen. Dit wijst op een centrale rol voor transport en fosforylering in het waarnemen van extracellulaire glucose. Bovendien zijn suikertransport en fosforylering zelf gereguleerd door verschillende signaaltransductiesystemen.
3.2.1. Glucose-repressie of ‘catabolite repression’: sensing door hexokinase
Repressie-effecten van glucose spelen zich hoofdzakelijk af op het transcriptionele niveau. Glucose represseert de transcriptie van de genen voor respiratie (enzymen van de Krebs-cylcus en de elektronentransportketen), gluconeogenese, de glyoxylaatcyclus, GAL, SUC en MAL genen voor het gebruik van alternatieve suikers en de genen betrokken bij het gebruik van ethanol, lactaat en glycerol. Hoge beschikbaarheid van glucose inhibeert ook genen voor hoge-affiniteits glucosetransporters. Ook de inducers van genen voor het gebruik van alternatieve koolstofbronnen worden vaak door glucose gerepresseerd. Tenslotte wordt ook een grote groep STRE-genen (stress response element) gerepresseerd, die de respons op verschillende stressfactoren mediëert.
Het sensing mechanisme dat de glucose-repressie signaalweg activeert, vereist transport, fosforylatie en geen verdere metabolisatie van glucose. Dit werd aangetoond met 2-deoxyglucose en fosfoglucoisomerase-mutanten (Pego et al., 1999). Glucosetransport lijkt enkel nodig te zijn om de aanvoer van glucose voor fosforylering te verzorgen (Reifenberger et al., 1997). Dit maakt aannemelijk dat er geen rol is voor glucosetransporters in dit proces. Drie suiker-kinasen, hexokinase (Hxk) 1 en 2 en glucokinase (Glk1), katalyseren de fosforylering van glucose, maar de glucoserepressie vereist specifiek Hxk2. Dit is het meest actieve suikerkinase van de drie, vooral in fermenterende gistcellen. Het blijft echter onduidelijk hoe Hxk2 precies betrokken is bij glucose-repressie.
Er zijn studies uitgevoerd die een correlatie aantoonden tussen de activering van de glucose-repressie en de kinase-activiteit van mutante allelen van Hxk2, wat suggereert dat hexosefosfaten als signaalmolecule zouden dienen (Rose et al., 1991). Later zijn echter ook mutante allelen geďdentificeerd waarin deze fenomenen van elkaar ontkoppeld zijn, wat eerder wijst op een signaleringsrol voor het actieve Hxk2 . De transitietoestand van het enzym-substraat-complex zou dan specifiek interageren met de volgende component van de signaaltransductieweg. (Hohman et al.,1999)
Door vergelijking van giststammen die verschillende combinaties van deze enzymen tot expressie brengen, is het belang van de verschillende hexose kinasen voor de glucoserepressie opgehelderd. Een initiële respons wordt gemedieerd door alle enzymen die glucose fosforyleren, wat doet vermoeden dat glucose-6-fosfaat het signaal doorgeeft. Langetermijnrepressie door glucose daarentegen, vereist specifiek Hxk 2. Hxk1 en Glk1 worden gerepresseerd na toevoegen van glucose en hun activiteit wordt bovendien door het cAMP-afhankelijk proteďne kinase, PKA, gereguleerd. (De Winde et al., 1996)
Recente gegevens tonen aan dat Hxk2 een directe rol heeft in het signaleren van glucose aan het repressie-apparaat. Hxk2 bevindt zich zowel in de nucleus als in het cytoplasma. De aanwezigheid in de nucleus is noodzakelijk voor glucose-repressie; bovendien is aangetoond dat Hxk2 deel uitmaakt van DNA-proteďne complexen met regulatorische elementen van de SUC2 promoter. (Herrero et al., 1998) Dus Hxk2 zou het glucose-signaal kunnen doorgeven door directe interactie met transcriptiefactoren, die de expressie van glucose-gerepresseerde genen controleren.
3.2.2. Glucose-inductie: glucose-sensing door ‘metabolische boodschappers’ en glucosetransporter-homologen.
Omdat fermentatie een relatief inefficiënte manier is om energie te winnen, in vergelijking met respiratie, is een hoge glucoseflux noodzakelijk. In aanwezigheid van glucose vergroten gistcellen de glycolytische capaciteit door inductie van een groot aantal glycolytische genen. Bovendien verhoogt de opname van glucose door de inductie van verschillende glucosetransporter genen (HXT genen). Hier zijn aparte signaaltransductiewegen bij betrokken. Mutantenstudies hebben aangetoond dat de verhoogde concentraties van verschillende metabolieten de inductie van de glycolytische genen initieert. (Boles et al., 1993) Verschillende glycolytische intermediairen blijken als signaalmolecule (metabolic messenger) te werken in de adaptatie van de cel aan wijzigende concentraties van fermenteerbare suikers. Dit gebeurt op een complexe, maar sterk gecontroleerde en efficiënte manier.
Twee leden van de glucosetransporterfamilie, Snf3 en Rgt2, vertonen geen actief transport maar hebben een regulatorische functie. Snf3 is noodzakelijk voor de inductie van transcriptie van HXT2, HXT3 en HXT4, hoge-affiniteits transporters, door lage concentraties aan glucose, terwijl Rgt2 vereist is voor de maximale inductie van het HXT1 gen, dat codeert voor de lage-affiniteits transporter Hxt1, door hoge concentraties aan glucose (Özcan et al., 1995; Özcan et al., 1996). Dit is o.a. aangetoond door analyse van een dominante puntmutatie in Rgt2 die constitutieve glucose-onafhankelijke expressie van HXT1 veroorzaakt. Als men dezelfde puntmutatie in Snf3 introduceert, komt HXT2 constitutief tot expressie. Rgt2 is de sensor voor hoge extracellulaire glucoseconcentraties, Snf3 is de sensor voor lage glucoseconcentraties. Snf3 wordt door glucose gerepresseerd, terwijl Rgt2 constitutief aanwezig is. (Rolland et al., 2002) De structuur van Rgt2 en Snf3 is vooral verschillend ten opzichte van andere glucosetransporters omwille van het lange C-terminale uiteinde dat zich in het cytoplasma bevindt en essentieel is voor de werking als glucosereceptor. Van twee proteďnen, Mth 1 en Std1, is aangetoond dat ze binden aan de C-terminale uiteinden van de receptoren. Deze hebben een repressief effect op de expressie van de hexosetransporters en het invertase, wat suggereert dat ze betrokken zijn in de transductie van het glucose-signaal voor regulatie van de expressie van SUC2 en de HXT genen. (Lafuente et al., 2000; Schmidt et al., 1999)
3.2.3. Geactiveerd PKA fenotype: de Ras-cAMP signaalweg en de FGM signaalweg
Heel veel eigenschappen van gistcellen worden gereguleerd door PKA. Alleen als alle voorwaarden voor fermentatieve groei vervuld zijn (aanwezigheid van een fermenteerbare koolstofbron en van een bron van elk van de elementen stikstof, zwavel en fosfaat) is PKA blijvend geactiveerd. Actief PKA zorgt voor een versnelde celcyclus en een verhoogde expressie van ribosomale genen. De sporulatiecapaciteit is verlaagd, maar de mogelijkheid om pseudohyfen te vormen verhoogd. De celwand is zwakker bij het geactiveerd PKA fenotype, de concentratie aan reservestoffen is lager, en de stress-resistentie is verminderd.
Glucose en andere snel fermenteerbare suikers zijn gekende activators van de cAMP signaalweg in gist. Naast glucose kan ook intracellulaire verzuring de cAMP signaalweg activeren. Tot voor kort dacht men dat zowel glucose als intracellulaire verzuring de signaalweg activeerde via Cdc 25 en de Ras proteďnen. In 1998 werd echter door Colombo et al. aangetoond dat de hoevelheid GTP gebonden op de Ras-proteďnen niet gewijzigd werd door toediening van glucose aan gederepresseerde cellen, maar enkel na verzuring van de cellen. Zij toonden aan dat een ander Gα-proteďne, Gpa2, betrokken was in de glucose-geďnduceerde activatie van de cAMP-signaalweg. Gpa2 is een heterotrimeer G-proteďne waarvan deletie de activatie van de signaalweg verhindert, wat erop wijst dat het vereist is voor activatie van de cAMP-signaalweg door glucose.
Via gist ‘two hybrid’ screening werd Gpr1 geďsoleerd als interagerend proteďne met Gpa2 (Xue et al., 1998; Kraakman et al., 1999). Tegelijkertijd werd Gpr1 ook ontdekt via mutant-analyse, door screening voor mutanten met deficiëntie van fermentatie-geďnduceerd verlies van hitteschok resistentie. De fil2 mutant bevat een ‘ochre non-sense’ mutatie in een intracellulaire lus van Gpr1, met verlies van de Gpr1-functie tot gevolg. In een gelijkaardige mutant-analyse werd ook RGS2 geďsoleerd, een gen dat codeert voor een proteďne met een typisch RGS-domein (Regulator of heterotrimeric G-protein Signaling), Rgs2, dat de GTPase activiteit van Gpa2 stimuleert en het cAMP-signaal dus doet afnemen.
Gpr1 is noodzakelijk voor de glucose-geďnduceerde activatie van de cAMP synthese en heeft alle specifieke kenmerken van een GPCR. Samen met het gegeven dat Gpa2 vereist is voor activatie van de cAMP-signaalweg, duidt dit aan dat glucose-sensing voor activatie van adenylaat cyclase gebeurt via het GPCR systeem dat bestaat uit de glucose-receptor Gpr1 en zijn geassocieerd Gα-proteďne Gpa2. Dit komt overeen met het activatiemechanisme dat gekend is in hogere organismen. Het is bovendien het eerst ontdekte voorbeeld van een nutriënt-geactiveerd GPCR-systeem in eukaryote cellen. In Schizosaccharomyces pombe en in Candida albicans werden homologen gevonden van Gpr1, wat het bestaan van een GPCR-familie betrokken in glucose-sensing doet vermoeden (Versele et al., 2001)
Controle over de cAMP-signaalweg gebeurt op meer dan één niveau. Naast het Gpr1-Gpa2 GPCR systeem is de activatie van de Ras-cAMP signaalweg ook afhankelijk van opname en fosforylatie van glucose (Buellens et al., 1988). Het lijkt erop dat fosforylatie noodzakelijk is om het adenylaat cyclase gevoelig te maken aan stimulatie door Gpa2. Onlangs is aangetoond dat extracellulaire glucose aanleiding geeft tot het cAMP signaal in giststammen die geen glucose opnemen (hxt1-7 hexosetransporter deletie stammen) op voorwaarde dat er een inwendige bron van het suiker aanwezig is om een laag niveau van glucose fosforylering te onderhouden (Rolland et al., 2000). Dit werd bereikt door pre-additie van een kleine hoeveelheid maltose, dat door een specifieke maltosetransporter wordt opgenomen en het cAMP signaal niet induceert. Dit cAMP signaal dat door extracellulaire glucose geďnduceerd wordt is strikt afhankelijk van de aanwezigheid van Gpr1. Met gebruik van gelijkaardige experimenten werd ook aangetoond dat het Gpr1-afhankelijke cAMP-signaal specifiek is voor glucose en sucrose, geen van de andere suikers of suiker-analogen die werden getest konden de activatie initiëren.
Deletie van Gpr1 resulteert enkel in een vertraging van de veranderingen van de PKA-doelwitten om zich aan te passen aan groei op glucose, maar de typische PKA-gecontroleerde fenotypes tijdens de fermentatieve groei worden niet beďnvloed. Activatie van de Ras-cAMP signaalweg na glucose-inductie veroorzaakt een tijdelijke stijging van het cAMP gehalte in de cel en heeft slechts een tijdelijk effect op PKA en haar doelwitmoleculen. Nochtans blijft PKA tijdens de groei op glucose en andere fermenteerbare koolstofbronnen actief. Bovendien wordt de PKA-activiteit onderdrukt in een voedingsmedium waarin een fermenteerbare koolstofbron aanwezig is, maar een ander essentieel nutriënt, zoals stikstof, ontbreekt. Deze eigenschappen veronderstellen een signaalweg die informatie betreffende de aanwezigheid van alle essentiële voedingsstoffen in het milieu integreert en een fysiologische respons medieert via PKA. Omwille van de behoefte aan zowel glucose en aan een compleet groeimedium werd deze signaalweg de FGM-signaalweg (Fermentable Growth Medium) genoemd (Thevelein, 1994). Het vermoeden dat er een signaalweg bestaat die PKA activeert, onafhankelijk van cAMP, wordt op twee manieren bevestigd. Enerzijds doordat cAMP synthese niet wordt geactiveerd tijdens de groei op glucose. Anderzijds wordt PKA op een cAMP-onafhankelijke manier geactiveerd als men stikstof toevoegt aan een stikstof-gedepriveerde gistcultuur, die over een fermenteerbare koolstofbron beschikt.
De schijnbare affiniteit van Gpr1 voor zijn vermeende ligand, glucose, is zeer laag: er is 20 ŕ 30 mM glucose nodig om de helft van de maximale activatie van het cAMP signaal te bekomen in vivo. Dit is in overeenstemming met de fysiologische context waarin Gpr1 functioneert: de transitie van een respiratief naar een fermentatief metabolisme gebeurt pas volledig bij glucose-concentraties van minstens 20mM (Thevelein, 1991). Andere systemen nemen glucose al waar in het micromolair gebied. Gpr1 speelt dus een rol in het detecteren van hoge beschikbaarheid van glucose in het medium. Na de snelle activatie van PKA door de Ras-cAMP weg, neemt de FGM-signaalweg deze functie over tijdens de groei op glucose. De Ras-cAMP weg fungeert als boodschapper die tijdens de overgang van niet-fermenteerbaar naar een fermenteerbaar medium de cel in staat stelt zich snel aan te passen.
Het proteďne kinase Sch9 is betrokken bij de FGM signaalweg. Deletie van SCH9 veroorzaakt een partieel groeiprobleem en verhindert trehalase-activatie door een stikstofbron in cellen die opgegroeid zijn in een stikstof-vrij glucose-bevattend medium, terwijl deletie van GPR1 of GPA2 hier geen invloed op heeft. Bijkomende deletie echter van GPR1 of GPA2 in een sch9Δ mutant schakelt de groei omzeggens geheel uit. Dit suggereert dat Gpr1 en Gpa2 niet betrokken zijn in de activatie van de FGM signaalweg. In een stam waar glucose fosforylatie onmogelijk is (hxk1Δ hxk2Δ glk1 Δ), of in gpr1Δ is er nog steeds een stikstof-geďnduceerde trehalase-activatie aanwezig (Pernambuco et al., 1996). Dit toont aan dat het Gpr1-Gpa2 systeem vereist is voor activatie van de FGM pathway wanneer fosforylering van de suiker afwezig is. Dit staat in tegenstelling met de glucose-activatie van de cAMP signaalweg, waar zowel extracellulaire suikerdetectie als intracellulaire fosforylering noodzakelijk zijn (Lemaire, 2000). Ook voor de activatie van de FGM signaalweg is nog niet duidelijk hoe suikerfosforylering en suikerdetectie met elkaar verbonden zijn.
Heel recent werd door ‘SCAM analyse’ (Substituted Cysteďne Accessibility Method) en door gedetailleerde analyse van puntmutaties aangetoond dat glucose en sucrose direct aan Gpr1 binden, meer bepaald aan transmembraandomein 6 (TM6). (Lemaire et al., 2003 submitted)
4. Glucose-sensing in zoogdieren
4.1 Glucosehomeostase: glucose-sensing in de β-cellen van de pancreas
In zoogdieren doet glucose dienst als de voornaamste suiker in het bloed en de concentratie ervan wordt nauwkeurig gecontroleerd, zodat deze binnen een specifiek interval blijft. Het onderhouden van een constant glucosegehalte in het bloed vereist een glucose-sensing mechanisme dat in staat is de hoeveelheid glucose in het bloed waar te nemen. Deze functie wordt uitgeoefend door de β-cellen van de pancreas, die bij het waarnemen van een stijging van het glucosegehalte in het bloed insuline zullen secreteren. Insuline stimuleert de opname van glucose bij vele celtypes en vooral bij levercellen, waar de suiker wordt opgeslagen als glycogeen. Hierdoor daalt de hoeveelheid glucose in het bloed. De homeostatische functie van de ß-cellen is afhankelijk van de opname van glucose door deze cellen en van de daaropvolgende transductiewegen die de exocytosesnelheid beďnvloeden.
De opname van glucose door de β-cellen wordt verzorgd door GLUT2 glucose transportmoleculen, die door de β-cellen tot expressie worden gebracht in de plasmamembraan. Deze moleculen laten een snel transport toe van glucose, onafhankelijk van de extracellulaire glucoseconcentratie. Na opname door de β-cellen worden de glucosemoleculen gefosforyleerd, en vervolgens opgenomen in de glycolyse. Indien lage gehaltes van glucose aanwezig zijn, wordt er slechts weinig glucose gefosforyleerd, hoogstwaarschijnlijk ten gevolge van een lage expressie van hexokinase isovormen met hoge affiniteit (hexokinase I, hexokinase II of hexokinase III). Bijgevolg is er slechts een lage glycolytische flux waardoor de ATP/ADP verhouding aan de lage kant blijft (Schuit et al., 2001). Bij hogere glucosegehaltes gebeurt de fosforylatie van glucose door hoog-affiniteits glucokinase (hexokinase IV), een enzyme dat in β-cellen gereguleerd wordt door subcellulaire lokalisatie (Rolland et al., 2001). Hierdoor verhoogt de glycolytische flux en bijgevolg stijgt de ATP/ADP verhouding. Deze verschuiving bij de adenine nucleotiden zorgt ervoor dat ATP-gevoelige kaliumkanalen zullen sluiten. De daling van de hoeveelheid ADP draagt ook bij tot dit effect. In aanwezigheid van Mg2+ werkt ADP de inhiberende werking van ATP tegen via de sulfonylurea receptor 1 (SUR1), de geassocieerde regulatorische subeenheden van de ATP-gevoelige K+ kanalen (Shyng et al., 1998). Door sluiting van deze kanalen treedt membraandepolarisatie op. Als gevolg van deze depolarisatie openen de voltage-afhankelijke calciumkanalen, waardoor de intracellulaire calcium concentratie stijgt. Deze stijging induceert de exocytose van insuline door get versmelten van secretorische vesikels met de plasmamembraan.
De glucose signalen voor secretie van insuline werken synergistisch met de door glucagon geďnduceerde stijging van de hoeveelheid intracellulair cAMP. Het exacte mechanisme van dit synergisme is nog niet gekend maar waarschijnlijk vindt deze plaats ter hoogte van de doelwitproteďnen die tussenkomen in de exocytose. De normale snelheid van door glucose geďnduceerde vrijzetting van insuline wordt dus door minstens twee mechanismen onderhouden. Het eerste mechanisme is een versnelling van de metabolische flux, die gecontroleerd wordt ter hoogte van de fosforylatie van glucose door glucokinase. Het tweede mechanisme is de produktie van cAMP, die gestimuleerd wordt door glucagon en de incretine hormonen GLP-1 en GIP (Schuit et al., 2001).
Het gen van glucokinase wordt in β-cellen gereguleerd door een zwakke promotor. Dit zorgt ervoor dat de expressie van dit enzyme in β-cellen aan de lage kant blijft in vergelijking met parenchymcellen van de lever. Hierdoor is de glucokinase activiteit in ß-cellen de snelheidsbepalende stap in het glucosemetabolisme. Er werd reeds aangetoond dat kleine veranderingen in de hoeveelheid glucokinase de gevoeligheid van de cellen voor glucose beďnvloeden, terwijl een grote toename van de expressie van glucokinase de glucose-sensing eigenschappen sterk verstoort (Schuit et al., 2001).
In een poging nieuwe componenten te isoleren die tussenkomen in glucose-sensing in ß-cellen werd gezocht naar genen uit deze beta-cellen die in staat waren het lethaal effect te suppresseren van de dubbele deletie van Sch9 en Gpr1 in gistcellen. Verschillende cDNA's die op deze manier geďsoleerd werden, coderen voor proteďnen met gekende functies, en hun effect in deze screening kan begrepen worden aan de hand van deze functies. Bijkomend werden drie nieuwe genen met ongekende functie geďsoleerd. Hoewel de groei van de getransformeerde cellen heel wat trager was dan de groei van wild type cellen, werd de levensvatbaarheid van de dubbele mutanten hersteld. Het cDNA met het sterkste effect werd geselecteerd voor verdere studie. Analyse van de DNA sequentie doet vermoeden dat het om een transcriptiefactor gaat. De 'Mammalian Transcription factor Activating the cAMP pathway in yeast' of MTAC, een proteďne met 574 aminozuren, is in gistcellen gelokaliseerd in de kern en is in staat op zichzelf de expressie van een reportergen te stimuleren in een two-hybrid experiment. Micro-array analyse heeft aangetoond dat de expressie van verschillende genen gestimuleerd of geďnhibeerd wordt door MTAC, en analyse van de promotors van deze genen resulteerde in een aantal mogelijke herkenningssequenties. Het is nog niet duidelijk of MTAC zelf rechtstreeks op het DNA bindt.
4.2. Regulatie van glucosetransport in de zoogdierdarm.
Naast de mechanismen die instaan voor het waarnemen en reguleren van de glucoseconcentratie binnen het lichaam, moeten zoogdieren ook de aanwezigheid van glucose aan de buitengrenzen van hun lichaam kunnen detecteren. Ter hoogte van de smaakpappilen en het darmepitheel wordt de aanwezigheid van glucose rechtstreeks gedetecteerd, onafhankelijk van de glucoseconcentratie in het bloed.
4.2.1. Anatomie en fysiologie van de dunne darm.
Actieve en passieve absorptie van nutriënten uit het voedsel gebeurt volledig ter hoogte van de dunne darm en zijn structuur en activiteit zijn daaraan aangepast. De dunne darm van zoogdieren wordt begrensd door het darmepitheel, dat dankzij de vele plooien en vingervormige uitstulpingen (villi) een groot oppervlak beslaat. De enterocyten vormen een gepolariseerd epitheel, de ene kant van het membraan van de cellen verschilt in structuur en functie van de andere kant. ‘Dichte juncties’ vormen de grens tussen het apicale en het basolaterale oppervlak van de cellen. Naargelang de fysiologische rol van het epitheel waar dichte juncties deel van uitmaken zijn ze al dan niet permeabel. De dichtheid van het dichte junctie netwerk wordt in de darm gereguleerd vanuit de cel.
Het apicale oppervlak is nog vergroot door talloze membraanuitstulpingen met actinefilamenten als skelet (microvilli) en is gespecialiseerd in absorptie van nutriënten. De toppen van de microvilli worden bedekt door de glycocalyx, die bestaat uit een los netwerk van oligosaccharidezijketens van membraanproteďnen, glycolipiden en verteringsenzymen. De borstelzoom of ‘brush border’ is de aflijning tussen het darmlumen en het cytosol van de enterocyten en bestaat uit de glycocalyx en de microvilli, het apicale gedeelte van het membraan wordt ook wel ‘brush border membrane’ of borstelzoommembraan genoemd. Het basolaterale oppervlak van de darmepitheelcellen is gespecialiseerd in diffusie van suikers en aminozuren uit de enterocyt naar de extracelullaire ruimte.
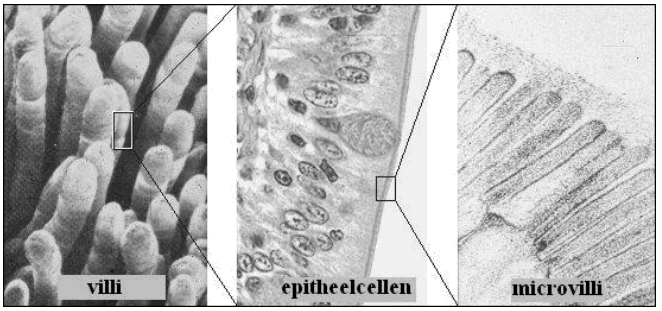
Fig.4 Door vergroting van het oppervlak verhoogt de absorptiecapaciteit van het darmepitheel.
4.2.2. Absorptie van monosacchariden in de dunne darm.
Suikers zijn de voornaamste energiebron in alle fasen van het leven van zoogdieren. De suikers die in het voedsel aanwezig zijn (lactose, zetmeel,…) worden afgebroken tot monosacchariden door amylasen uit het speeksel en pancreassap en door disaccharidasen in de glycocalyx. Bij het transepitheliale transport van stoffen maken we onderscheid in transport dóór de cel (transcellulair) en transport lángs de cel (paracellulair). Het is aangetoond dat glucosetransport over het darmepitheel een actieve en een passieve component heeft (Debnam en Levin, 1975).
4.2.2.1. Actief glucosetransport
Transcellulair transport gebeurt altijd in twee stappen. Nutriënten worden door volgroeide enterocyten aan de top van de darmvilli opgenomen. In een tweede stap gaan de monosacchariden van het cytoplasma van de enterocyt naar de extracellulaire ruimte om uiteindelijk in het bloed opgenomen te worden.
Glucose en galactose worden, tegen hun concentratiegradiënt in, over het borstelzoom-membraan getransporteerd door de Na+/suiker co-transporter, (‘Sodium Glucose Linked Transporter1’ SGLT1). Met elk molecule glucose dat SGLT1 in de enterocyt binnenbrengt, komen twee Na+-ionen mee. Om de stijging van de osmolariteit te compenseren diffunderen ongeveer 1100 moleculen water door het membraan er per molecule glucose. Voor efficiënte opname van water is actief transport van osmolieten noodzakelijk.
SGLT1 transporteert glucose en Na+-ionen volgens een ‘alternating access’ mechanisme. Eerst binden twee natriumionen aan het extracellulaire gebied van SGLT1, waardoor de conformatie zodanig verandert dat glucose of galactose kan binden. Dan worden de twee Na+ en het suikermolecule over het membraan getransporteerd door middel van een andere conformatieverandering (gecoördineerde rotatie en/of ‘tilt’ van de transmembraanhelices). Glucose wordt dan eerst losgelaten in het cytoplasma en daarna de twee Na+. Dit wordt bevorderd door de lage affiniteit van de cytoplasmatische glucose/galactose bindingsplaats en de lage intracellulaire concentratie aan natriumionen. De ligand-vrije transporter relaxeert dan terug tot de conformatie waarbij de bindingsplaatsen naar buiten gericht zijn. Elke transporter doorloopt deze cyclus ongeveer 1000 keer per seconde bij 37°C. (Wright et al., 2003) Dit proces is energetisch mogelijk doordat het 3Na+/2K+ -ATPase natriumionen over het basolaterale membraan uit de cel pompt (verbruik van ATP) en een Na+-gradiënt veroorzaakt. Transport van monosacchariden doorheen het borstelzoommembraan is dus een secundair actief proces. De binnengepompte kaliumionen diffunderen terug naar buiten door een K+ -kanaal, waardoor een binnenkant-negatieve potentiaal ontstaat. SGLT1 transporteert per glucose twee Na+-ionen, waardoor het epitheel van de dunne darm in staat is glucose te transporteren tegen een heel grote concentratiegradiënt. Bij evenwicht van SGLT1 is de intracellulaire glucoseconcentratie 30000 maal groter dan de glucoseconcentratie van de darminhoud. Fructose wordt passief opgenomen uit de darminhoud, GLUT5 faciliteert de diffusie van fructose over de borstelzoom. Eenmaal geabsorbeerd, worden galactose en fructose meestal omgezet in glucose-6-fosfaat voor opname in het metabolisme.
Voor de tweede transportstap is geen energie vereist, GLUT2 faciliteert diffusie van glucose, galactose en fructose over het basolaterale membraan. De glucosecarrier GLUT2 heeft twaalf transmembraandomeinen, het bindt glucose aan de ene kant van het membraan en laat het los aan de andere kant. Transport van glucose gebeurt in beide richtingen, dit is noodzakelijk om de epitheelcellen van glucose te voorzien bij een suikervrij diëet. Het netto-transport van glucose gebeurt altijd in de richting van de glucose-gradient. GLUT2 valt dus te vergelijken met een kanaal voor glucose, waardoor een evenwicht kan ontstaan van de glucoseconcentraties in de compartimenten die door het membraan gescheiden worden.
De gegevens van Stümpel et al. (2001) suggereren een alternatief mechanisme waarbij fosforylatie van glucose en transport naar het endoplasmatisch reticulum noodzakelijk zijn voor de export uit de enterocyten. Als GLUT2 niet aanwezig is, wordt glucose nog wel over het basolaterale membraan getransporteerd, maar dit wordt verhinderd door glucose-6-fosfaat translocase inhibitoren. Het suiker wordt dan door middel van exocytose naar het extracellulair vocht gebracht.
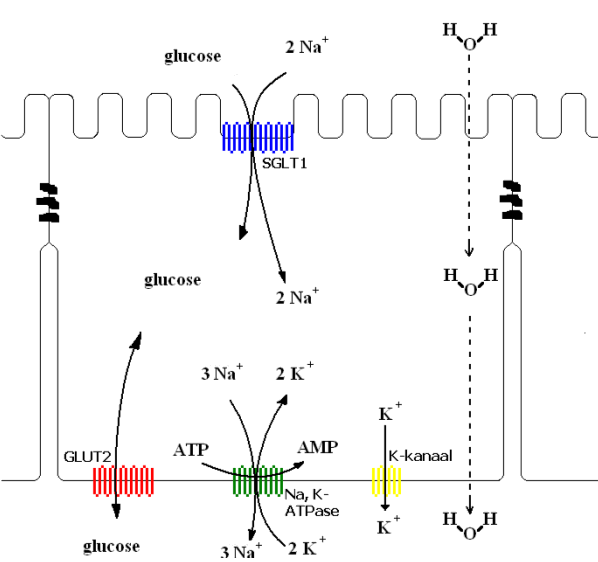
Fig.5: Mechanisme van het (secundair) actief glucosetransport over het darmepitheel
4.2.2.2. Passief glucosetransport.
De laatste vijftien jaar heeft zich een debat ontwikkeld over het mechanisme van de passieve component van glucose-absorptie in de darm. Pappenheimer en Reiss (1987) stelden voor dat ‘paracellular solvent drag’ bijdraagt aan een passieve component van het glucosetransport, die bij hoge glucoseconcentraties groter is dan de SGLT1-gemediëerde actieve component. Deze hypothese houdt in dat opgeloste nutriënten uit de darm worden opgenomen door de osmotische flux van water doorheen de poriën van de dichte juncties. Het ‘openen’ van de dichte juncties is afhankelijk van Na+/nutriënt cotransport.
Helliwell en Kellett (2000) spreken de hypothese van Pappenheimer tegen en tonen aan dat de passieve component van het glucosetransport te wijten is aan transport door GLUT2 over het borstelzoommembraan. GLUT2 is daar niet constitutief aanwezig, maar wordt door actief glucosetransport geďnduceerd. Studies met phloretine en phloredzine, specifieke inhibitoren van respectievelijk GLUT2 en SGLT1, tonen aan dat GLUT2 een aanzienlijk aandeel heeft in de glucose-absorptie, bij hoge glucoseconcentraties aan de lumenale zijde van het borstelzoommembraan. (Fig.6) (Kellett, 2001)
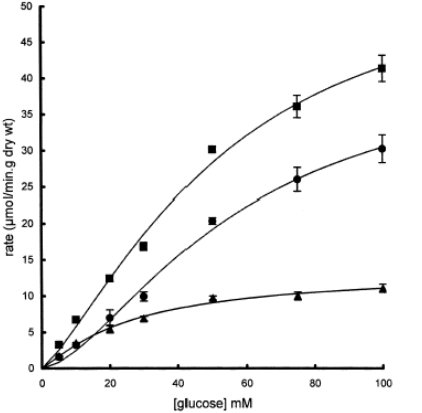
Fig6. : Het aandeel van glucosetransporters SGLT1 en GLUT2 in de totale absorptie van glucose over het darmepitheel. ▲: Phloretine-ongevoelig: SGLT1; ●: Phlorezine-ongevoelig: GLUT2; ■: glucosetransport zonder inhibitoren. (Kellett, 2001)
4.2.3. Glucose-sensing in de zoogdierdarm
De darmepitheelcellen worden voortdurend blootgesteld aan sterke variaties in de concentraties van monosacchariden. Dit in tegenstelling tot de meeste andere zoogdiercellen, die baden in een intern medium met een glucoseconcentratie die door endocriene werking constant wordt gehouden. Het is essentieel dat de zoogdierdarmcellen de glucoseconcentraties in de darm snel waarnemen en zich eraan aanpassen. Het is aangetoond dat monosacchariden in het lumen van de darm van een brede groep van diersoorten een regulerend effect hebben op de activiteit van de transporters, vergelijkbaar met wat in gistcellen is waargenomen.
De dunne darm van herkauwers (ruminantia), is een uniek modelsysteem voor studies op de regulatie van SGLT1. In het verteringsstelsel van een zogend lam is het rumen nog niet ontwikkeld, en is er ook geen ruminale microflora. Alle suikers uit de melk worden bijgevolg opgenomen in de dunne darm. Het rumen ontwikkelt zich als het diëet verandert van melk naar gras, bij het spenen. De ruminale microflora fermenteert cellulose en andere opgenomen suikers tot vluchtige vetzuren, waardoor praktisch geen glucose of galactose nog de dunne darm bereikt. De vluchtige vetzuren worden opgenomen en in de lever gebruikt voor gluconeogenese. De overgang van het zogend (pre-ruminant) stadium naar het gras-etend (ruminant) stadium brengt een dramatische daling teweeg in de hoeveelheid en de activiteit van het SGLT1 proteďne en dit is het directe gevolg van de sterke terugval van de glucose-concentratie in het darmlumen. Rechtstreeks toedienen van glucose, galactose, fructose, α-methyl –D-glucose en 3-O-methyl-D-glucose in de dunne darm van een volwassen schaap (m.b.v. een duodenale canule) zorgde voor een verhoogde expressie van SGLT1, tot het expressieniveau van een pre-ruminant lam. Op dezelfde wijze toonde men aan dat ook suikers die geen substraat zijn voor SGLT1 (2-deoxy-D-glucose) en niet metaboliseerbare glucose-analogen (methyl-α-D-glucopyranoside en 3-O-methyl-α,D-glucopyranoside) de expressie van SGLT1 activeren. Het kunstmatig verlengen van het melkdieet stelde de daling van het aantal transporters uit. (Shirazi-Beechey et al., 1991)
Om te achterhalen of glucose moet getransporteerd worden om SGLT1 te induceren werd een wateroplosbare, metabolisch inerte, en membraan-impermeabel glucose-analoog gesynthetiseerd: twee glucosemoleculen worden met koolstof 6 gebonden aan de wateroplosbare en door zijn grootte ontransporteerbare polymeer Poly (Ethyleen Glycol)600 (PEG600). De structuur en stabiliteit van de macromolecule en de afwezigheid van vrij glucose in de oplossing werd bevestigd door fysische, chemische en enzymatische analyses. De infusie van di(glucose-6-yl)PEG600 in de dunne darm van het schaap leidt tot de inductie van functioneel SGLT1 in het apicale membraan van de enterocyten. Infusie van PEG600. veroorzaakt dit niet. Deze gegevens tonen aan dat glucose in het lumen wordt gedetecteerd door een glucosereceptor aan de externe zijde van het borstelzoom-membraan van de darmepitheelcellen (Dyer et al., 2003). De bindingsplaats heeft een suikerspecificiteit verschillend van SGLT1 en binding brengt een intracellulair signaal voort dat onafhankelijk van het glucosemetabolisme leidt tot de activering van SGLT1 gentranscriptie.
Om de mechanismen die betrokken zijn in de suiker-geďnduceerde expressie van SGLT1 te achterhalen, werden verschillende in vitro systemen onderzocht. De muis entero-endocriene cellijn STC-1 is een zeer geschikt systeem. Deze cellen vormen in cultuur een gepolariseerd epitheel met dichte juncties. De STC-1 cellijn vertoont dezelfde glucose-responsiviteit als natieve enterocyten. De abundantie van het SGLT1 proteďne verhoogt sterk bij toevoegen van glucose aan het medium. (Dyer et al., 1997b) De LLC- PK1 cellijn is afgeleid van de epitheelcellen van de proximale tubulus van de varkensnier. De regulatie van SGLT1 in niercellen gelijkt op die van enterocyten en STC-1 cellen. Peng en Lever (1995) namen in de LLC-PK1 cellijn een grote, cAMP afhankelijke stijging van de expressie van SGLT1 waar, zoals in enterocyten en STC-1 cellen. De Caco-2 cellijn is een veelgebruikt in vitro modelsysteem dat afgeleid is van humane colon-adenocarcinoma cellen, die veel eigenschappen van volgroeide enterocyten vertonen. Deze cellen zijn een waardevol modelsysteem voor studies op de functie en differentiatie van darmcellen.
Dyer et al. (2003) toonden aan dat de cAMP-concentratie in STC-1 cellen 32% steeg als de cellen van een medium met 5mM glucose overgebracht werden in een medium met 25 mM glucose. Bij additie van de PKA-agonist 8-Br-cAMP aan celculturen met lage glucose-concentratie, steeg de expressie van SGLT1 ongeveer evenveel als bij blootstelling aan 25 mM glucose. Ook in schapendarm veroorzaakte infusie van 8-Br-cAMP stimulering van de SGLT1 promoteractiviteit. De PKA-inhibitor, H-89, deed in beide celtypes de glucose-geďnduceerde stijging van SGLT1 teniet. Deze data stroken ook met de waarnemingen in de LLC-PK1 cellijn. (Loflin en Lever, 2001)
Al deze gegevens ondersteunen het bestaan van een G-proteďne-gekoppelde-receptor (GPCR) voor glucose, gekoppeld aan een G-proteďne dat adenylaat cyclase activeert in het apicale membraan van de enterocyten. De activiteit van cAMP afhankelijk proteďne kinase (PKA) stimuleert dan de expressie van de SGLT1 glucose transporters. Het is in het belang van het organisme dat deze receptor door lage glucoseconcentraties wordt geactiveerd. Het achterhalen van de componenten van deze signaalweg zou een doorbraak zijn in het onderzoek naar de nutriënt-sensing mechanismen van de eukaryote cel.
Hirsch et al. (1996) gebruikten Xenopus oöcyten waarin het konijnen SGLT1 gen tot expressie werd gebracht om de regulatie te bestuderen. Bij activatie van PKA, door toevoegen van 8-Br-cAMP, namen ze een stijging in het glucosetransport waar van 30%. Activatie van Ca2+ afhankelijk proteďne kinase PKC, door toevoegen van sn-1,2-dioctanoylglycerol (DOG), deed de activiteit van SGLT1 60% dalen. Clancey en Lever (2000) tonen ook in de LLC-PK1 cellijn aan dat PKC en PKA tegenovergestelde effecten hebben op de hoeveelheid SGLT1 in het borstelzoommembraan.
4.2.4. Regulatie van de hoeveelheid SGLT1-transporters in het borstelzoommembraan
4.2.4.1. Transcriptie
Lescale-Matys et al. namen in 1993 waar dat Glucose-geďnduceerde expressie van SGLT1 in het schapendarmepitheel slechts gedeeltelijk te wijten is aan verhoogde transcriptie. Het SGLT1 gen wordt ongeveer vier maal meer overgeschreven naar mRNA als respons op een verhoogde luminale suikerconcentratie.
Vayro et al., (2001) onderzochten het promotergebied van SGLT1 en toonden aan dat een gebied dat overeenkomt met het HNF-1 consensus bindingsdomein noodzakelijk is voor glucose-responsiviteit van transcriptie. Er is tevens een gecorreleerde daling van de hoeveelheid HNF-1 (hepatic nuclear factor-1) en SGLT1 mRNA in de darmepitheelcellen, bij overgang van het pre-ruminante naar het ruminante stadium en een overeenkomstige stijging bij glucose-infusie van de dunne darm van volwassen schapen. Binding van HNF-1 op de promotersequentie van SGLT1 in vitro werd aangetoond aan de hand van DNA mobiliteits-shift experimenten. HNF-1 werkt dus vermoedelijk als transcriptie-activator van SGLT1 en komt tot expressie als glucose gedetecteerd wordt in de dunne darm. In celkernen van glucose-geďnfuseerde schapendarmepitheelcellen werd twee tot driemaal zoveel nieuw gesynthetiseerd SGLT1 mRNA gevonden als in niet-geďnfuseerde controledieren. Verhoogde transcriptie alleen kan niet verantwoordelijk zijn voor de meer dan vijftigvoudige verhoging van het intacte SGLT1 mRNA die gedetecteerd werd door Northern-blot analyse van mucosale schraapsels uit het jejunum, waarin cytoplasmatisch RNA aanwezig is. De belangrijkste regulatie van SGLT1 gebeurt dus post-transcriptioneel.
4.2.4.2. mRNA stabiliteit
Loflin en Lever (2001) toonden aan dat HuR (Humaan antigen R) bindt aan een uridine rijk element van 47 ribonucleotiden in het 3’ onvertaalde deel van het SGLT1 mRNA in LLC-PK1 cellen. HuR is een RNA bindend proteďne, gekend voor zijn stabilizerende werking op uridine rijke sequenties. Een AU Rijk Element (ARE) in het 3’ onvertaalde gedeelte van een mRNA is een cis element dat snelle degradatie bevordert
Een belangrijke eigenschap van HuR is dat het tussen de nucleus en het cytoplasma pendelt (Fan en Steitz, 1998). Recent is een specifiek endo(ribo)nuclease ontdekt dat uridine-rijke mRNA sequenties splitst (het trans-element), waardoor het RNA snel afgebroken wordt door exonucleasen (Zhao et al., 2000). HuR zou dus, door binding in de buurt van de endonuclease herkenningsplaats, het SGLT1 mRNA onbeschikbaar maken voor endonucleolytische activiteit tijdens de verplaatsing van de celkern naar de ribosomen op het ruw endoplasmatisch reticulum.
Met behulp van de fosfodiësterase-inhibitor IBMX kon men in de LLC-PK1 cellen waarnemen dat er bij verhoogde cAMP-concentratie meer HuR aan de URE van SGLT1 mRNA bindt. Fosfatasewerking op een extract van celkernen van met IBMX behandelde cellen doet de binding van HuR aan het uridine-rijk element afnemen. (Loflin en Lever, 2001) Dit betekent dat de stabilisatie van het mRNA afhankelijk is van fosforylatie van één of meerdere cellulaire proteďnen. Men vermoedt dus activatie door de cAMP-PKA fosforylatiecascade
De aanwezigheid van HuR in de darm van muizen is aangetoond door Lu en Schneider (2004). Muis en mens SGLT1 mRNA bevatten beiden twee AUUUA sequenties in het 3’ onvertaalde uiteinde, gekend als bindingsplaats voor HuR. Wat gekend is van de sequentie van het schaap SGLT1 mRNA (Tarpey, 1995) heeft slechts een kort 3’ onvertaald gedeelte, dat geen uridine rijke elementen bevat. Het is mogelijk dat regulatie op het niveau van RNA-stabiliteit niet aanwezig is in het schaap, dan moet de regulatie van het glucosetransport in de schapennier ook verschillen van het mechanisme in de varkensnier, of althans van het mechanisme in de LLC-PK1 cellijn.
4.2.4.3. Vesikeltransport
Wright et al. stelden in 1997 vast dat activatie van PKA en PKC geen verandering in de kinetische eigenschappen van de SGLT1 transporter induceert en dat regulatie te wijten is aan een gewijzigd aantal transporters in het membraan. Zij onderzochten korte-termijneffecten geďnduceerd door stimulatie van PKA en PKC op de abundantie van SGLT1 transporters in het membraan van Xenopus oöcyten die humaan SGLT1 tot expressie brengen en stelden regulatie ter hoogte van vesikeltransport vast. Zij vonden ook consensus fosforylatiesites voor PKA en PKC op de intracellulaire lussen van de transporter.
In 2003 toonden Wright et al. aan dat de recessieve afwijking ‘glucose-galactose malabsorption’ (GGM), waardoor de patient diarree heeft zolang er glucose of galactose in het dieet zit, te wijten is aan een mutatie in het SGLT1 gen. Ze stelden vast dat de suikertransporters wel aangemaakt worden, maar het plasmamembraan niet bereiken. Er is dus een verstoorde regulatie ter hoogte van het vesikeltransport, die afhankelijk is van de aminozuursequentie van SGLT1 zelf. Het feit dat glucose in de darm van patiënten met GGM de absorptie van andere nutriënten en water verstoort, is een aanwijzing dat de aanwezigheid van glucose een receptor stimuleert op het borstelzoommembraan. Het intracellulaire signaal van deze receptor maakt dat de cellen in de eerste plaats glucose willen opnemen, ten koste van het transport van andere nutriënten.
Kipp et al. (2003) toonden in de Caco-2 cellijn aan dat zich dubbel zoveel transporters op intracellulaire vesikels bevinden dan op het plasmamembraan. Immunocytochemische kleuringen toonden aan dat vesikels geladen met SGLT1, geassocieerd zijn met het cytoskelet en dat exocytose en endocytose gebeurt onafhankelijk van organellen die instaan voor het centrale proteďne synthese/degradatie traject. (Fig.7)

Fig.7 Intracellulaire vesikels met SGLT1 zijn geassocieerd met microtubuli in de Caco-2 cellijn. (Kipp et al., 2003)
Recente studies (Veyhl et al., 2003) op Xenopus oöcyten die humaan SGLT1 tot expressie brengen, tonen aan dat PKC en dynamine betrokken zijn in het inhiberende effect van het regulatorisch proteďne RS1 op de expressie van SGLT1. Dynamine is een GTP-ase dat onder andere betrokken is in de voltooiing van endocytose. Als RS1 niet aanwezig is zorgt activatie van PKC voor stimulatie van exocytose van humaan SGLT1. Een activator van PKC (leptine) inhibeert galactose-absorptie en een PKC-inhibitor (chelerythrine) gaat dit effect tegen. (Barrenetxe et al., 2004)
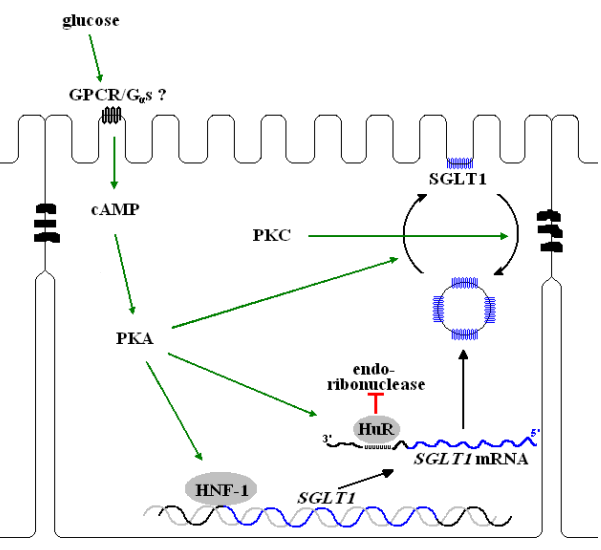
Fig.8: De regulatie van de hoeveelheid SGLT1 gebeurt op verschillende niveaus: transcriptie (aangetoond in de STC-1 cellijn, Vayro et al., 2001), mRNA stabiliteit (aangetoond in de LLC-PK1 cellijn, Loflin en Lever, 2001) en vesikeltransport (aangetoond in getransfecteerde Xenopus oöcyten, Wright et al., 1997 en de Caco-2 cellijn, Kipp et al., 2003)
4.2.4.4. Een verband tussen het regulatiemechanisme en het onderzochte organisme.
Het menselijke eetgedrag vereist van de darm dat ze op korte tijd veel voedingsstoffen opneemt. De korte-termijn verhoging van het aantal transporters in het membraan is waarschijnlijk te wijten aan versnelde exocytose van vesikels verzadigd met transporters. Voor blijvende veranderingen, zoals de ontwikkeling van het rumen bij herkauwers, gebeurt de regulatie ter hoogte van transcriptie. De fermentatie door de rumenale microflora verhindert dat suikers de darm bereiken, ook als een volwassen schaap terug zou beginnen zogen. Een snelle respons op glucose is in deze dieren dus veel minder belangrijk. Hoewel de regulatiemechanismen van SGLT1 zich op een verschillend niveau afspelen in verschillende weefsels en organismen, zijn ze allemaal afhankelijk van PKA. Het is dus mogelijk dat alle glucose-geďnduceerde mechanismen door dezelfde geconserveerde receptor voor glucose gemedieerd worden.
4.2.5. De rol van PKC in glucose-sensing
Hoewel de ‘paracellular solvent drag’ hypothese van Pappenheimer en Reiss (1987) voor passieve opname van glucose in de darm lange tijd veel bijval heeft gekend, tonen de gegevens van Kellet en Helliwel (2000) aan dat GLUT2 verantwoordelijk is voor de stijging van de transportsnelheid van glucose boven de verzadigingsgraad van SGLT1. De activiteit van SGLT1 verhoogt de hoeveelheid competent PKC βII isozyme, onafhankelijk van Ca2+ en ook de MAPK (mitogen activated proteďn kinase) signaalweg is hierbij betrokken. Omdat ook mannitol dit effect veroorzaakt maar niet wordt getransporteerd, suggereren deze onderzoekers dat er zich mogelijk een specifieke receptor voor glucose in het borstelzoommembraan bevindt. Deze receptor zou dan via een Ca2+-signaal competent PKC βII activeren om het aantal GLUT2 transporters te verhogen. (Helliwell et al., 2003). Zij vermoeden een rol voor het niet transporterende lid van de Na+ -cotransporters, SGLT3. Diez-Sampedro et al. (2003) toonden echter aan dat dit proteďne niet in enterocyten tot expressie komt. Een glucose-geactiveerd GPCR-systeem is een andere mogelijkheid. Het is dus mogelijk dat er zich twee GPCR’s voor glucose in het borstelzoommembraan bevinden. (Fig. 9)
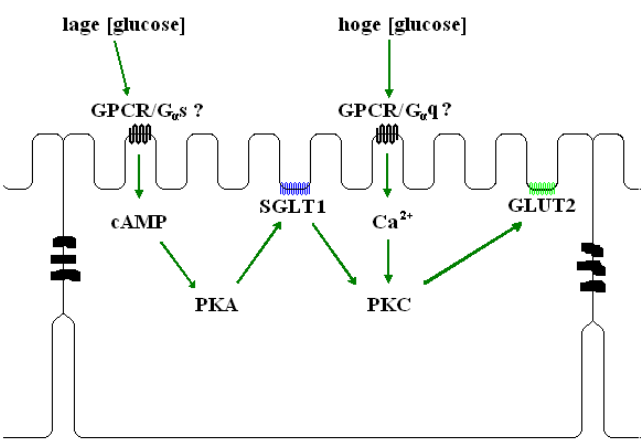
Fig.9: Hypothese omtrent de rol van glucose-geactiveerde GPCR-systemen in de regulatie van suikertransport. Bij detectie van glucose in de darm wordt het actief transport geactiveerd via de cAMP-PKA signaalweg. Als er echter hoge glucose-concentraties (meer dan 50 mM) worden gedetecteerd medieert PKC de activatie van het gefaciliteerde transport, door verhoging van het aantal GLUT2 transporters in het borstelzoommembraan. Samengesteld aan de hand van gegevens uit Dyer et al., 2003 en Helliwell et al., 2003
Deze waargenomen activatie van het gefaciliteerd transport zorgt niet voor een vermindering van de actieve component van het glucosetransport (Kellet, 2001). Het inhiberende effect van PKC op SGLT1 waargenomen door Hirsch et al. komt hiermee niet overeen. Een mogelijke uitleg is dat de detectie van een nutriënt verschillend van glucose, een Ca2+-signaal induceert in de enterocyten. In afwezigheid van actief glucosetransport, leidt dit tot de vermindering van het aantal SGLT1 transporters en een verhoging van het aantal transporters voor dat bepaalde nutriënt. In de STC-1 cellijn zorgt de detectie van aggregaten van lange-keten vetzuren bijvoorbeeld voor een verhoging van de intracellulaire Ca2+-concentratie in een signaalweg die leidt tot secretie van cholecystokinine, een stof die de afgave van galzouten bevordert (Benson et al., 2002).
Het ultieme doel van dit project is het gen te identificeren dat codeert voor de G-proteďne gekoppelde receptor (GPCR) die verantwoordelijk is voor het suiker-sensing mechanisme dat de inductie medieert van de Na+/glucose cotransporter SGLT1. De doelstelling van mijn thesisonderzoek is de structurele screening van de epitheelcellen: de GPCR’s identificeren die in het darmepitheel van de muis tot expressie komen, aan de hand van PCR- en hybridisatie-gebaseerde technieken. Op die manier bekomen we een verzameling van genen voor GPCR’s waartussen zich de glucosesensor kan bevinden.
Structurele screening wordt uitgevoerd met behulp van DOP-PCR amplificatie van mRNA uit darmepitheelcellen van muizen. Dit is PCR met gedegenereerde primers, gebaseerd op alignering van geconserveerde sequenties die overeenkomen met transmembraandomeinen van gekende GPCR’s, waarna de sequentie van het PCR-product wordt bepaald. Anderzijds wordt ook met RT-PCR naar gekende weesreceptoren gezocht in het mRNA uit de epitheelcellen van de dunne darm van de muis.
Een andere benadering bestaat uit de analyse van een micro-array, die heel wat genen voor GPCR’s bevat en onderworpen werd aan hybridisatie met mRNA dat uit STC-1-cellen geďsoleerd werd. De aanwezigheid van de weesreceptoren die op de micro-array een signaal gaven wordt dan getest door RT-PCR op het RNA dat uit de dunne darm van muizen werd geďsoleerd.
Door Q-PCR en micro-array analyse van het RNA van STC-1 celculturen die in media met verschillende glucose-concentraties zijn opgekweekt, kunnen eventuele verschillen in expressie aangetoond worden. Dit kan een eerste aanwijzing zijn voor de functie van receptorgenen.
In de verdere stappen van dit project zullen de kandidaat-glucosereceptors het onderwerp zijn van functionele screening. Enerzijds kan men in een gist-systeem achterhalen of de expressie van één van de kandidaten het groeidefect van de gpr1Δ sch9Δ stam kan opheffen en nagaan of dit afhankelijk is van de aanwezigheid van glucose. Men kan ook nagaan of één van de GPCR’s in staat is cAMP synthese te activeren als respons op het toevoegen van glucose. De laatste doelstelling zal zijn om de activiteit van de receptor in muizencellen aan te tonen met behulp van RNAi en kameelantilichamen. Functionele screening behoort echter niet tot de doelstellingen van mijn thesisonderzoek.
Voor de functionele screening is het volledige coderende gebied van de receptor-mRNA’s nodig, geflankeerd door restrictieplaatsen die directionele klonering in een expressievector mogelijk maken. Dit gebeurt door RT-PCR met primers die het volledige coderende gebied van het mRNA amplificeren en aan het 5’ einde een sequentie bevatten die niet met het mRNA basepaart, maar een restrictie-knipplaats aan het PCR-product toevoegt.
1. RNA
Isolatie en zuivering van RNA uit darmepitheelcellen werd door Jane Dyer uitgevoerd aan de universiteit van Liverpool, met gebruik van de RNeasy Mini Kit van Qiagen, gevolgd door DNase-behandeling. De stalen waren afkomstig uit het duodenum, jejunum en ileum van de muizendarm. Ook uit STC-1 cellen werd het RNA geďsoleerd, enerzijds uit een celcultuur die op 5 mM glucose werd opgekweekt, anderzijds uit een celcultuur die 25 mM glucose bevatte. Details over de isolatie van het RNA zijn te vinden in het artikel van Vayro et al. (2001).
2. cDNA synthese
cDNA kan aangemaakt worden door het enzyme Reverse Transcriptase. Dit enzyme maakt DNA aan op basis van RNA en vertoont een hoge stabiliteit bij temperaturen hoger dan 50°C. Het opgezuiverde mRNA wordt naar cDNA vertaald. Er wordt hierbij gebruik gemaakt van oligo(dT) primers die aan de polyA-staarten van de mRNA’s binden. Na de RT-reactie wordt RNAse H toegevoegd om het mRNA af te breken. In eerste instantie werd het RNA van de drie gedeelte van de dunne darm apart omgezet naar cDNA en onderworpen aan PCR. Om sneller en goedkoper te werken werden daarna gelijke hoeveelheden RNA uit duodenum, jejunum en ileum samengevoegd.
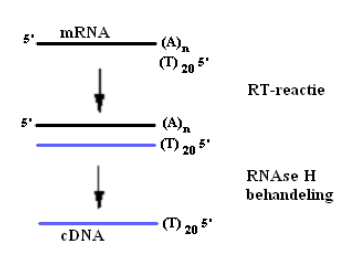
Fig. 1: cDNA synthese
2.1. Materiaal (Thermoscript™ RT kit, invitrogen)
- mRNA
- 50 µM oligo(dT)20
- 10 mM dNTP mix: 10mM Adenosine, 10 mM Guanosine, 10 mM Cytosine,
10 mM Thymidine
- Thermoscript™ Reverse Transcriptase (15 U/µl)
- 5x cDNA synthese buffer: 250 mM Tris acetaat (pH 8.4), 375 mM Kalium acetaat,
40 mM magnesiumacetaat
- 0.1 M dithiothreitol (DTT)
- RNaseOUT™ (50 U/µl): RNase-inhibitor
- E coli RNase H (2 U/µl)
- DEPC-behandeld water
2.2. Methode
- Pipeteer 2 µg RNA in een microcentrifugeerbuisje op ijs.
- Voeg 1 µl oligo(dT) oplossing toe.
- Voeg 2 µl dNTP-mix toe.
- Vul aan met DEPC-water tot 12 µl.
- Plaats 5 minuten op 65 °C en daarna terug op ijs.
- Bereid een reactiemengsel voor de RT-reactie op ijs, 8 µl per reactie bestaande uit:
- 4 µl cDNA syntesebuffer (5x)
- 1 µl DTT
- 1 µl RNase OUT
- 1 µl ThermoscriptRT
- Voeg 8 µl reactiemengsel bij de 12 µl oligo(dT)-primed RNA.
- Plaats 1 uur op 65°C en 5 minuten op 85 °C.
- Voeg 1 µl RNase H toe
- Plaats 20 minuten op 37 °C en 10 minuten op 65 °C
- Voeg 60 µl MilliQ-water toe.
- Bewaar het cDNA op -20 °C.
3. PCR
3.1. algemeen
De Polymerase Chain Reaction is een techniek waarbij een stuk DNA in vitro wordt geamplificeerd. Er wordt hierbij gebruik gemaakt van het enzyme Taq polymerase. Primers zijn oligonucleotiden die complementair zijn met sequenties van hetzelfde gen, en die bij binding een initiatieplaats vormen voor DNA-Polymerase. Het Taq Polymerase is afkomstig van Thermus aquaticus, een bacterie die leeft in warmwaterbronnen en beschikt over hittebestendige enzymen. Taq Polymerase is optimaal actief bij 72°C en verliest zijn werking niet bij zeer hoge temperaturen.
PCR gebeurt in drie stappen die samen één cyclus vormen. In een eerste stap (denaturatie), wordt het DNA gedenatureerd, de waterstofbruggen tussen de basen van de twee DNA strengen worden verbroken door de hoge temperatuur. Bij 95 °C komt enkel nog enkelstrengig DNA voor. De tweede stap (annealing) stap, laat hybridisatie van de primers met het enkelstrengig DNA toe. De temperatuur tijdens deze stap is minstens 2 graden lager dan de smelttemperatuur van de primers (Tm). Onder invloed van het Taq polymerase zullen in de derde stap (elongatie) de gehybriseerde primers verlengd worden. Zo worden de nieuwe complementaire strengen aangemaakt. Het polymerase werkt in de 5’ → 3’ richting. Deoxynucleoside-5’-trifosfaten (dNTP’s) worden aangehecht aan het 3’ uiteinde van de (verlengde) primer waarbij twee fosfaatgroepen worden afgesplitst. De derde stap gebeurt bij 72 of 68 °C, naargelang het gebruikte enzyme. De kopies van beide DNA strengen en de beide strengen zelf worden als templaat gebruikt voor een volgende amplificatieronde. Alleen als aan beide complementaire strengen een primer bindt, en het 3’ uiteinde van de ene primer in de richting van de andere primer wijst is exponentiele amplificatie mogelijk. Deze cyclus wordt meestal 35 maal doorlopen. Minder cycli betekent minder amplificatie, meer cycli vergroot de kans op fouten in het replicatieproces.
De duur van de verschillende stappen hangt af van het DNA polymerase en de lengte van het amplicon. De eerste denaturatiestap duurt langer dan de andere denaturatiestappen om het cDNA volledig te denatureren. De laatste elongatiestap wordt ook vaak verlengd, opdat alle strengen afgewerkt zouden worden en zodat elk dubbelstrengig PCR product een 3’ afhangend adenosine-residu heeft, ten gevolge van de Terminaal-Transferase-activiteit van Taq Polymerase.
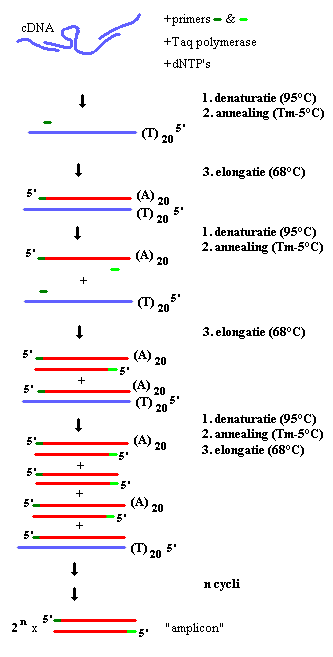
Fig. 2 : PCR op basis van cDNA
3.1.1. Materiaal
- cDNA
- primers: 10 µM werkoplossing.
- 10 mM dNTP mix: 10mM Adenosine, 10 mM Guanosine, 10 mM Cytosine,
10 mM Thymidine
- 10x PCR buffer
- 50 mM MgSO4
- Platinum® Taq Polymerase
- Thermocycler Westburg
3.1.2. Methode
- Pipeteer 2 µl cDNA in een microcentrifugeerbuisje van 200 µl.
- Pipeteer van elk van beide primeroplossingen 1,5 µl bij het cDNA.
- Maak een reactiemengsel (45 µl per reactie) van 5 volumes 10x PCR buffer, 2 volumes
MgSO4, 1 volume dNTP mix, 36,8 volumes MilliQ water en 0,2 volume Taq polymerase.
- Voeg 45 µl van het reactiemengsel in elk van de microcentrifugeerbuisjes.
- Voer het temperatuurprogramma in het geheugen van het PCR-apparaat in, of selecteer een
bestaand programma. Start het programma, plaats de microcentrifugeerbuisjes pas in het
apparaat als het blok volledig opgewarmd is.
3.2. DOP-PCR (Degenerate Oligonucleotide Primed PCR)
Degenerate Oligonucleotide Primed PCR (DOP-PCR) is een techniek die toelaat om verschillende DNA sequenties tegelijk te amplificeren, op voorwaarde dat ze geflankeerd worden door gebieden die sterk op elkaar gelijken. Gedegenereerde primers bestaan eigenlijk uit een mengsel van oligonucleotiden, die wel grotendeels gelijk zijn, maar op enkele plaatsen een verschillende base bevatten. Als men wil bereiken dat de primer op een bepaalde positie zowel aan Adenine, Guanine en Cytosine basepaart kan men ook een hypoxanthine-residu invoeren (het nucleoside heet dan Inosine, I). De primers worden gebaseerd op een geconserveerde aminozuursequentie, waarvan men door ‘back-translation’ de consensus-nucleotidesequentie heeft bepaald. Elk van de oligonucleotiden in het mengsel heeft zijn eigen smelttemperatuur. Men neemt daarom best de smelttemperatuur van het meest AT-rijke oligonucleotide in beschouwing bij het bepalen van de annealing-temperatuur. Om een zekere graad van aspecifieke primerbinding toe te laten kan men de temperatuur van de annealing-stap in de eerste vijf cycli enkele graden verlagen.
Gedegenereerde primers voor transmembraandomeinen van GPCR’s werden in de literatuur gevonden, alsook het te gebruiken temperatuurprogramma. DOP-PCR op RNA van verschillende weefsels heeft tot de ontdekking van vele GPCR’s geleid. Het is een heel geschikte techniek om naar homologen van een gekend gen te zoeken als er weinig informatie over het genoom beschikbaar is.
3.3. RT-PCR (Reverse Transcriptase PCR)
De laatste jaren zijn honderden GPCR’s ontdekt waarvan de functie of het ligand niet gekend is, de zogenaamde weesreceptoren (orphan GPCR’s). Het is mogelijk dat één van deze weesreceptoren de door ons gezochte glucosesensor is. Omdat de precieze mRNA-sequentie van deze receptoren gekend is, kan men specifieke primers ontwerpen en op zoek gaan naar één bepaald receptor-transcript in het cDNA. Aan de hand van de lengte van het PCR-product kan men eventuele vals positieve resultaten onderscheiden van de gezochte receptor. Bijkomend voordeel is dat voor de sequentiebepaling geen kloneringsstappen en transformatie van E. coli cellen vereist is, de specifieke primers kunnen gebruikt worden voor directe sequentiebepaling van het PCR-product.
Specifieke primers werden ontworpen met Gene Runner® software. Deze omvatten een zo groot mogelijk gedeelte van het coderende gedeelte van het gezochte mRNA, zodat sequentiebepaling echt uitsluitsel kan geven over de identiteit van het PCR-product. Primers werden uitgezocht met een Tm van 58 tot 60 °C, die weinig baseparing met zichzelf of elkaar kunnen maken. Om tijd en kosten te sparen hebben we voor de tweede reeks receptoren enkel Q-PCR primers ontworpen en deze werden gebruikt om de gegevens van de microrooster-analyse te bevestigen met RT-PCR en agarosegel-electroforese.
Het gebruikte temperatuurprogramma voor PCR met Platinum® Taq Polymerase is:
1 minuut 94 °C
25 seconden 94 °C )
25 seconden 55 °C ) 34x
1 min 30 sec 68 °C )
pauze 4 °C
3.4. Materiaal
- cDNA
- primers: 10 µM werkoplossing.
- 10 mM dNTP mix: 10mM Adenosine, 10 mM Guanosine, 10 mM Cytosine,
10 mM Thymidine
- 10x PCR buffer
- 50 mM MgSO4
- Platinum® Taq Polymerase
- Thermocycler Westburg
3.5. Methode
- Pipeteer 2 µl cDNA in een microcentrifugeerbuisje van 200 µl.
- Pipeteer van elk van beide primeroplossingen 1,5 µl bij het cDNA.
- Maak een reactiemengsel (45 µl per reactie) van 5 volumes 10x PCR buffer, 2 volumes
MgSO4, 1 volume dNTP mix, 36,8 volumes MilliQ water en 0,2 volume Taq polymerase.
- Voeg 45 µl van het reactiemengsel in elk van de microcentrifugeerbuisjes.
- Voer het temperatuurprogramma in het geheugen van het PCR-apparaat in, of selecteer een
bestaand programma. Start het programma, plaats de microcentrifugeerbuisjes pas in het
apparaat als het blok volledig opgewarmd is.
4. Agarosegel-electroforese
Agarosegel-electroforese wordt na PCR toegepast om de aanwezigheid en de lengte van PCR producten na te gaan. Algemeen wordt deze techniek gebruikt om DNA fragmenten van verschillende lengte te scheiden. DNA is negatief geladen en migreert in een elektrisch veld naar de positieve pool (anode). Hoe korter de DNA fragmenten, hoe minder weerstand ze ondervinden van de agarosegel en hoe vlugger ze migreren. Op die manier bekomt men een scheiding van de verschillende DNA fragmenten volgens hun lengte. Om de lengte te bepalen, wordt hun migratie vergeleken met de migratie van een moleculaire merker in dezelfde agarosegel. Deze merker bevat fragmenten van gekende lengte.
Het DNA wordt zichtbaar gemaakt door middel van ethidiumbromide. Dit molecule heeft een hoge affiniteit voor dubbelhelix DNA, het is een vlak molecule dat intercaleert tussen twee opeenvolgende baseparen. De energie van het UV-licht (260 nm) dat door het DNA geabsorbeerd wordt, wordt door energie-transfer overgedragen aan etidiumbromide, dat daardoor fluoresceert in het zichtbare spectrum (590 nm).
4.1 Materiaal
- Agarose
- 10x TAE: Los 48.5 g Tris, 4.1g NaAc (=6.797 g NaAc.H2O) en 3.7 g Titriplex (EDTA)
(10mM) op in 950 ml gedistilleerd water. Breng de oplossing op pH 7.9 met NaOH en vul
aan tot 1 l met gedistilleerd water. Autoclaveer de oplossing
- 1x TAE: Giet 100 ml 10X TAE in een glazen fles en vul aan tot 1 l met gedestilleerd water.
- Bakje, schaaltje en kam voor het gieten van een gel.
- 6X Dye ( kleurstof)
- 10 mg xylenocyanol
- 10 mg bromofenolblauw
- 5 g sucrose
- 5 ml EDTA (100mM)
- DNA ladder GeneRulerFermentas:
- Electroforese-apparaat
- Ethidiumbromide (10 mg/ml stockoplossing)
- Schudplaat.
- UV-bron en fotografisch systeem
4.2. Methode
- 1,5 % agarosegel: Breng 1,5 g agarose in 100 ml 1x TAE in een erlenmeyer. Verwarm in de
microgolfoven tot het kookt. Giet de warme agarose-oplossing in een bakje waar een kam
op bevestigd is. Verwijder de kam als de gel gestold is, waar de kam was zijn nu
uitsparingen in de gel (slotjes) waar een klein volume vloeistof in gepipeteerd kan worden.
- Gelelectroforese: plaats de agarosegel in een electroforese-apparaat met de slotjes aan de
kant van de kathode. Overgiet met 1x TAE zodat de agarosegel net onder staat, in de slotjes
mag zich geen lucht bevinden.
- Meng 10 µl van het reactiemengsel na PCR met 2 µl loading dye en pipeteer dit in het slotje.
- Meng 2 µl DNA ladder met 2 µl loading dye en 8 µl water en pipeteer dit in een ander slotje.
- Schakel het electroforese-apparaat aan op 100 V, gedurende een uur.
- Meng 5 µl EtBr met 100 ml 1x TAE in een glazen bakje en leg de agarosegel hierin.
- Zet het bakje op het kantel-apparaat gedurende 15 minuten.
- Leg de gel op de UV-lichtbron en maak een foto.
5. Scheiden van PCR producten met verschillende lengtes.
5.1. Materiaal
- Zie 4.1.
- Scalpel
- 70 % Ethanol
5.1.2. Methoden
- Bereid een agarosegel zoals beschreven in 4.2. Gebruik een kam met brede tanden voor
brede slotjes. Voor de scheiding van twee PCR producten die weinig in lengte verschillen
kan men een 2 % agarosegel (2 g agarose in 100 ml 1x TAE).
- Voer electroforese uit zoals beschreven in 4.2. Neem nu echter 50 µl van het PCR
reactiemengsel en mengt met 10 µl loading dye.
- Gebruik het scalpel om de bandjes op de agarosegel uit te snijden.
- Steek het stukje agar met het bandje in een 1,5 ml microcentrifugeerbuisje
- Spoel het scalpel grondig met ethanol alvorens het volgende bandje uit te snijden.
6. Opzuivering van PCR product.
Om het PCR product te kunnen gebruiken voor klonering of sequenering, moet het ontdaan worden van nucleotiden, oligonucleotiden, polymerase en zouten. Als het product uit agarosegel moet worden opgezuiverd, gebruiken we de geneclean turbo kit en protocol. Als PCR slechts producten van één lengte heeft voortgebracht gebruiken we ethanolprecipitatie
6.1 Opzuiveren uit agarosegel: Geneclean turbo
6.1.1. Materiaal
- Geneclean Turbo® Kit, Qiagen:
- Filterbuisjes en opvangbuisjes
- Zoutoplossing
- Wasoplossing, ethanol toegevoegd.
- Elutiebuffer
- Centrifuge
6.1.2. Methode
- Voeg per mg uitgesneden gel 1 µl Turbo® zoutoplossing toe in een centrifugeerbuisje van
1,5 ml.
- Plaats 5 minuten op 55 °C.
- Vortex tot de vloeistof homogeen is.
- Breng maximum 500 µl in een filterbuisje dat op een opvangbuisje is geplaatst.
- Centrifugeer kort en ledig het opvangbuisje.
- Breng 500 µl Turbo® wasoplossing in het filterbuisje dat op een opvangbuisje is geplaatst.
- Centrifugeer kort en ledig het opvangbuisje.
- Centrifugeer gedurende 4 minuten op 6000 tpm.
- Plaats het filterbuisje op een steriel 1,5 ml centrifugeerbuisje.
- Breng 30 µl Turbo® elutiebuffer in het filterbuisje.
- Incubeer gedurende 5 minuten op kamertemperatuur.
- Centrifugeer gedurende 1 minuut op 6000 tpm
- Bewaar het gezuiverde DNA op -20 °C.
6.2. Ethanol-precipitatie.
6.2.1 Materiaal
- PCR product
- 0.3 M Natrium acetetaat in ethanol
- Glycogeen
- Diepvries -80 °C
- Microcentifuge 4 °C
6.2.2. Methode
- Vul het PCR product aan tot 100 µl met MilliQ water in een 1,5 ml microcentrifugeerbuisje.
- Voeg 300 µl Ethanol met 0.3 M Natrium Acetaat toe.
- Voeg 1 µl glycogeen toe.
- Plaats 20 minuten op -80 °C.
- Centrifugeer gedurende 20 minuten aan 14000 rpm op 4 °C.
- Neem het supernatans af en laat het sediment gedurende een uur drogen onder de laminaire
flow.
- Los het sediment op in 20 µl MilliQ water
- Bewaar op -20 °C
7. Klonering in pCR 2.1 vector en transformatie van competente E. coli cellen:
TA Cloning ® Kit (Invitrogen)
De TA Cloning® Kit is ontworpen om PCR producten in bacteria te cloneren zonder tussenkost van modifierende enzymen. Taq Polymerase heeft een beperkte terminale transferase activiteit: aan het 3’ uiteinde wordt een extra deoxyadenosine aangehecht. pCR 2.1 heeft aan beide 3’ uiteinden een afhangende deoxythymidine, dit laat efficiente ligatie tussen het PCR product en de vector door T4 DNA ligase toe. De oriëntatie van het ingebrachte DNA kan door sequenering bepaald worden.
Selectie van transformanten met een recombinant plasmide gebeurd met ampicilline en blauw-wit selectie. pCR 2.1 bevat het gen voor β-lactamase, waardoor transformante cellen resistent zijn voor ampicilline. Cellen die geen vector bevatten vormen geen kolonies op een medium met ampicilline. De insertie van het PCR product gebeurt in het promotergebied van het LacZα gen, dat codeert voor het N-terminale gebied van β-galactosidase. De bacteriële cellen bevatten het gen dat codeert voor het C-terminaal gedeelte van dit enzyme. De β-galactosidase fragmenten op zichzelf zijn niet actief. In vivo kunnen beide fragmenten elkaar aanvullen tot een actief enzyme. Dit enzyme katalyseert de hydrolyse van lactose en 5-bromo-4-chloro-3-indolyl-β-galactoside (X-gal). De splitsing van X-gal door dit enzyme resulteert in het blauwe 5-bromo-4-chloro-indol, dat neerslaat in de cellen. Isopropyl β-D-thiogalactopyranoside (IPTG) activeert de transcriptie van LacZα. De cellen die met de niet-recombinante vector getransformeerd werden, synthetiseren het LacZ complementatiefragment na inductie met IPTG en worden blauw in een medium dat X-gal bevat. Cellen die de recombinante vector bevatten blijven wit omdat het LacZα geďnactiveerd is door insertie, er wordt geen functioneel complementatiefragment gesynthetiseerd.
De One Shot® chemisch competente E. coli cellen zijn uiterst temperatuur gevoelig en worden bij -80 °C bewaard. Deze cellen nemen DNA op uit hun omgeving zolang ze niet aan hoge temperaturen worden blootgesteld. Een warmteschok na de incubatie met het plasmide zorgt ervoor dat de poriën van deze cellen zich sluiten, waardoor de vector niet meer naar buiten kan diffunderen. Na opgroeien op LB medium met ampicilline, IPTG en X-gal selecteert men de witte kolonies voor de bereiding van het plasmide DNA
7.1 Materiaal
- vers PCR product
- zoutoplossing: 1.2 M NaCl, 0.06 M MgCl2
- MilliQ water
- pCR® 2.1 vector 3.9 kb: 10 ng/µl plasmide DNA in 50% glycerol, 50mM Tris-HCl
(pH 7.4), 1 mM EDTA, 1mM DTT, 0.1% Triton X-100, 100µg/ml BSA, fenolrood
- 10x ligatiebuffer
- T4 DNA-ligase
- One Shot® chemische competente E. coli cellen
- SOC medium: 2% Tryptone, 0.5% Yeast extract, 10mM NaCl, 2.5 mM KCl, 10mM MgCl2
10mM MgSO4, 20mM glucose
- LB agarplaten met ampicilline (100µg/ml):
- X-Gal (40mg/ml)
- Thermoblock: Eppendorf Thermoshaker
- Schudincubator: innova 4000
7.2 Methode
7.2.1 Ligatie
- Pipeteer in een 1,5 ml centrifugeerbuisje:
- Een volume PCR-product dat overeenkomt met 10 ng (0,5 ŕ 2 µl)
- 2 µl pCR® 2.1 vector
- 1 µl 10x Ligatiebuffer
- 1 µl T4 DNA Ligase
- vul aan tot 10 µl met MilliQ water.
- Incubeer de ligatiereactie gedurende één nacht op 14 °C
- Centrifugeer kort en plaats op ijs.
7.2.2 Transformatie en vorming van kolonies
- De E. coli cellen worden uit de diepvries genomen en onmiddellijk op ijs geplaatst om te
ontdooien. Tegelijkertijd wordt het SOC medium (-80°C) op 37 °C gebracht.
- Pipetteer 2 µl van het ligatiemengsel in de tube met de E. coli cellen en meng voorzichtig.
- Incubeer gedurende 30 minuten op ijs.
- Plaats gedurende 30 seconden in een verwarmingsblok op 42 °C
- Breng het buisje terug op ijs.
- Voeg onder de laminaire flowkast 250 µl SOC medium toe aan de tube.
- Schud de cellen gedurende minimum 1 uur in de Incubator Shaker (225 rpm, 37°C).
- Neem een agarplaat met ampicilline en waar 20 µl X-gal en 40 µl IPTG aan toegevoegd
werd en strijk 100 µl van het transformatiemengsel uit op de plaat.
- Incubeer overnacht bij 37°C.
- Door de platen op 4 °C te plaatsen ontwikkelt zich de kleur van de kolonies. De platen
worden op 4 °C bewaard.
8. Bereiding van plasmide DNA volgens de CTAB methode: miniprep
Deze methode wordt gebruikt om plasmide DNA op te zuiveren uit E. coli celculturen door het afbreken van de celwand met lysozyme en EDTA, het chromosomaal DNA blijft aan de celmembraan gehecht en sedimenteert bij centrifugatie, terwijl het plasmide DNA in oplossing blijft.
8.1 Materiaal
- STET
- CTAB: 5% cetyl-trimethyl-ammoniumbromide, verwarmen vóór gebruik (37°C).
- 50 mg/ml lysozyme
- 1,2M NaCl
- TE
- 100% ethanol
8.2 Methode
- Neem één afzonderlijke kolonie, inoculeer in 3 ml LB met 50 µg/ml ampicilline en groei
overnacht in de schudincubator bij 37°C
- Centrifugeer 1,5 ml van de precultuur gedurende 1 min aan 8000 tpm
- Resuspendeer de cellen in een mengsel van 300 µl STET en 3 µl lysozyme
- Incubeer 5 min bij kamertemperatuur
- Verwarm 1 min bij 95 °C
- Centrifugeer 15 minuten aan 13000 tpm
- Verwijder het sediment, voeg 6 µl CTAB toe en vortex kort
- Centrifugeer 5 minuten aan 13000 tpm en verwijder het supernatans
- Resuspendeer het sediment in 300 µl 1,2M NaCl, voeg 750 µl 100% ethanol toe en plaats
gedurende 30 minuten bij -20 °C
- Centrifugeer 10 minuten aan 13000 tpm, verwijder het supernatans
- Centrifugeer opnieuw om alle vloeistof op de bodem van het microcentrifugeerbuisje te
verzamelen en verwijder het resterende supernatans
- Laat de buisjes gedurende 10 min openstaan zodanig dat het sediment volledig kan drogen
- Resuspendeer in 50 µl MilliQ water
- Stockeer het miniprep DNA bij -20°C
9. Bepaling van de concentratie van dubbelstrengig DNA.
Met behulp van een spectrofotometer kan men de concentratie van dubbelstrengig DNA bepalen van het PCR product of het opgezuiverde plasmide.
9.1. Materiaal
- Quartz cuvette van 1 ml.
- Spectrofotometer: Eppendorf BioPhotometer
9.2 Methode
- Los 5 µl van de DNA oplossing op in 500 µl MilliQ water
- Stel de spectrofotometer in op dsDNA, geef de verdunning in (5 + 500 µl)
- Spoel de cuvette voor elke meting met ethanol en MilliQ water.
- Vul de quartz cuvette met MilliQ water druk op ‘blanc’.
- Breng nu minstens 250 µl DNA oplossing in de quartz cuvette en druk op ‘sample’, de
meetresultaten worden afgeprint.
10. Sequenering.
De sequentie van PCR producten, kan bepaald worden met behulp van cyclische sequenering met dideoxynucleotiden (ddNTP’s) die elk een specifieke fluorescente probe dragen. PCR-producten die met specifieke primers tot stand zijn gekomen kunnen met dezelfde primers gesequeneerd worden. Producten van DOP-PCR worden als insert van een plasmide gesequeneerd, met een primer die op de vector bindt. Men voegt polymerase en één primer toe aan het PCR-product of plasmide, en een mengsel van alle dNTP’s en fluorescente ddNTP’s, en men voert een aantal PCR-cycli uit. PCR-reactie met slechts één primer levert lineaire amplificatie op van enkelstrengig DNA. Als een ddNTP ingebouwd wordt door het DNA Polymerase (zonder 3’5’ exonucleolytische activiteit) kan de duplicatieractie niet voortgezet worden. Het resultaat is een mengsel van ssDNA fragmenten met alle mogelijke lengtes groter dan de primer, waarvan het 5’ uiteinde telkens de primer is, en de fluorescentiekleur afhankelijk is van het nucleotide aan het 3’ uiteinde. Na 25 cycli wordt het DNA opgezuiverd door precipitatie in ethanol en gedenatureerd op 95°C. Scheiding van de fragmenten op basis van hun lengte gebeurt door middel van capilaire electroforese. Meting van de fluorescentie aan het uiteinde van het capilair levert de sequentie van het verlengde van de primer in 5’,3’-richting.
10.1 Materiaal.
- gezuiverd plasmide of RT-PCR product.
- 10 µM werkoplossing van beide primers (hetzij specifieke PCR-primers, hetzij M13 forward
en M13 reverse primers die met het plasmide binden aan weerszijden van het gekloneerde
DNA)
- Terminator Ready Reaction Mix (BigDye® terminator v3.1 sequencing Kit):
specifiek fluorescent gemerkte ddNTP’s, dNTP’s, MgCl2, Tris-HCl, AmpliTaq DNA Polymerase FS
- Westburg thermocycler
- 125 mM EDTA
- 3M Natrium Acetaat
- 100% ethanol
- centrifuge met adaptor voor 96-well plaat.
- ABI prism® 3100-Avant Genetic Analyzer: scheidt en detecteert fluorescent gelabelde DNA
fragmenten, de bijhorende software analyseert het chromatogram
10.2 Methode:
- Meet de concentratie van het gezuiverde DNA en verdun tot ongeveer 20 ng in 11 µl water.
- Voeg 1 µl van de werkoplossing van één van de primers toe.
- Breng de 12 µl DNA met primers in een 96-well plaat en voeg 8 µl Terminator Ready
Reaction Mix toe, goed mengen en kort centrifugeren.
- Voer PCR-cycli uit: 1 min 96°C, 25x (10 sec 96°C, 5 sec 50 °C, 4 min 60°C), 4°C
- Voeg 2 µl 125 mM EDTA toe
- Voeg 2 µl 3 M Natrium Acetaat toe
- Voeg 50 µl 100% Ethanol toe
- Sluit de 96-well plaat af met aluminiumtape en meng door 4 maal om te keren.
- Incubeer 15 minuten op kamertemperatuur.
- Centrifugeer 45 minuten op 1650 g op 4 °C.
- Keer de microtiterplaat om en centrifugeer kort tot 185 g.
- Voeg 70 µl 70 % Ethanol toe aan elke ‘well’
- Centrifugeer 15 minuten op 1650 g op 4 °C.
- Keer de microtiterplaat om en centrifugeer 1 minuut op 185 g.
- Laat de het sediment drogen op een donkere plek.
- Resuspendeer in injectiebuffer en voer in in de ABI prism® 3100-Avant Genetic Analyzer.
11. Analyse van sequenties.
Eerst moeten de twee sequenties, verkregen met de beide primers, samengevoegd worden tot één dubbelstrengig geheel. Dit werd met Gene Runner® software uitgevoerd. Als het PCR-product in een vector gekloneerd is voor sequenering, moeten aan weerszijden de sequenties afkomstig van de vector verwijderd worden. Als het PCR-product met de specifieke primers gesequeneerd werd, kan de primersequentie nu aan de juiste uiteinden toegevoegd worden.
Deze sequentie kan nu gebruikt worden door een ‘Basis Logical Alignment Search Tool’ (BLAST) om in een databank te zoeken naar gelijkenissen. Deze software geeft een score aan de overeenkomst tussen de opgegeven sequentie en elk van de sequenties in de databank, de resultaten met de hoogste score (meeste gelijkenis) worden weergegeven. De BLAST software is, onder zijn verschillende vormen beschikbaar op de website van het Amerikaanse ‘National Center for Biotechnology Information’ (http://www.ncbi.nlm.nih.gov/BLAST). Aan de hand van nucleotide-nucleotide BLAST kan men achterhalen of het PCR-product afkomstig is van een gekend gen. Anderzijds kan men met een ‘translate-tool’ de gecodeerde aminozuursequentie in de zes leesramen achterhalen. Als het geamplificeerde RNA voor een gedeelte van een proteďne codeert is er normaal één leesraam dat geen stop-codons bevat. Deze sequentie wordt gebruikt om te vergelijken met een proteďne-databank. Aan de hand van de homologie met gekende genen kunnen we een idee krijgen over de structuur en functie van het gecodeerde proteďne. De aminozuursequentie kan met behulp van de TMpred-tool (www.ch.embnet.org/software/TMPRED_form) geanalyseerd worden, sequenties met voornamelijk hydrofobe aminozuren, tussen de 17 en 30 aminozuren lang krijgen een score naargelang de waarschijnlijk dat het om een transmembraanhelix gaat, ook de meest waarschijnlijke oriëntatie van de TM’s wordt weergegeven. Prosite (www.expasy.org/prosite) is een databank van families en domeinen van proteďnen, vergelijking met deze databank kan informatie opleveren over de structuur en functie van het proteďneproduct van de mRNA sequentie.
Als er geen enkel leesraam is zonder stop-codons, kan dit te wijten zijn aan een fout in het analyseren van de sequentie, of een mutatie in de amplificeringsreactie. Men kan dan de echte proteďnesequentie proberen samen te stellen uit de langste open leesramen met dezelfde oriëntatie, door hypothesen te maken over de aard van de mutatie. Bij PCR-producten afkomstig van het muis-RNA kan men in een dergelijk geval de juiste nucleotidensequentie opzoeken in het transcriptoom van de muis en hieruit de correcte aminozuursequentie achterhalen. Als er geen enkel lang open leesraam is, is de kans groot dat de sequentie niet voor een proteďne codeert.
12. Q-PCR (Quantitative real-time PCR)
Quantitatieve PCR (Q-PCR) laat toe om de hoeveelheid van een bepaald mRNA in cellen of weefsels te schatten en de vergelijking te maken tussen verschillende condities. De experimentopstelling laat toe het amplificatieproces “in real time” te volgen: de hoeveelheid dsDNA wordt tijdens de reactie gevolgd met SYBR Green I dye®, een molecule dat fluoresceert als het aan dsDNA bindt. De cyclus waarbij de fluorescentie een bepaalde ‘treshold’ overschrijdt (Ct), geldt als maat voor de initiële concentratie van het cDNA. Alle reacties worden in drievoud uitgevoerd om eventuele fouten bij het pipetteren te herkennen en weg te laten.
Primers worden ontworpen met Primer Express® software. De primers omvatten een sequentie van 50 tot 150 basenparen aan de 3’ kant van het coderende gedeelte van het mRNA. De smelttemperatuur van de primers ligt tussen 58 en 60 °C. Reeksen van meer dan 4 gelijke basen na elkaar werden vermeden, en bij de laatste vijf basen aan de 3’ kant plaatst men niet meer dan drie G of C residu’s.
Vooraleer de werkelijke metingen worden uitgevoerd, worden de primers getest in verschillende concentraties (300mM en 500mM), de concentratie die de laagste Ct geeft wordt ook in de verdere reacties gebruikt. In een tweede test maakt men een verdunningsreeks van genomisch DNA om na te gaan binnen welk interval de resultaten betrouwbaar zijn.
Men kan de zuiverheid van het PCR-product nagaan door het te onderwerpen aan een geleidelijk stijgende temperatuur. De afgeleide van de dissociatiecurve moet uit één piek bestaan ter hoogte van de dissociatietemperatuur van het gewenste amplicon. Als de temperatuur waarbij de fluorescentie verdwijnt lager ligt dan de temperatuur die door de software werd voorspeld, bevindt er zich een korter amplicon in het PCR product, waarschijnlijk ontstaan doordat de primers elkaar binden met vorming van initiatieplaatsen voor DNA Polymerase. Als de temperatuur van dissociatie hoger ligt dan voorspeld door de software, kan dit te wijten zijn aan contaminatie met genomisch DNA of aan aspecifieke primerbinding.
Een ijkrechte wordt opgesteld door de Ct te bepalen van gekende concentraties van genomisch DNA. Het logaritme van de hoeveelheid genomisch DNA (in ng) (X-as) wordt in lineair verband gebracht met de Ct (Y-as). Door Q-PCR uit te voeren op een verdunningsreeks van genomisch DNA voor het opstellen van de ijkrechte, kan daarna de initiele concentratie van het cDNA uitgedrukt worden als ‘het aantal ng genomisch DNA dat nodig zou zijn in het reactiemengsel om dezelfde Ct te bekomen met dezelfde primers’, voor het gemak wordt dit C0 genoemd. Absolute quantificatie van een RNA species is niet mogelijk omdat de efficiëntie van de RT-reactie niet in rekening gebracht kan worden. De vergelijking van de expressie van verschillende genen is dus ook niet 100 % betrouwbaar. De verhouding van de C0’s van verschillende genen in hetzelfde mengsel geeft wel de verhouding in cDNA concentraties, op voorwaarde dat de efficientie van Q-PCR (af te leiden uit de standaardcurve) ongeveer gelijk is. Dit kan dus enkel dienen als aanwijzing om de transcriptie van verschillende genen in dezelfde conditie te vergelijken. Voor vergelijking van het expressieniveau van hetzelfde gen in verschillende condities bekijkt men hoe de C0 van het gen zich verhoudt tot de C0 van een ‘housekeeping’ gen, waarvan men weet dat de transcriptie niet verschilt in de twee condities.
Er wordt een ander reactiemengsel en protocol gebruikt dan dat van DOP-PCR en RT-PCR, maar het amplificatieprincipe is uiteraard hetzelfde. Primer-annealing en elongatie gebeuren op 60 °C gedurende één minuut, denaturatie gebeurt op 95 °C gedurende 15 seconden. Er worden 40 cycli uitgevoerd. Na de 40 cycli wordt de dissociatietemperatuur bepaald door het volgen van de fluorescentie bij trage toename van de temperatuur.
12.1. Materiaal
- Primers (10 pmol/µl)
- Eurogentec qPCR MasterMix plus for SYBR® green I
- ABI7000 (APPLIED BIOSYSTEMS)
12.2. Methode
- PCR-reactiemengsel:
12.5 µl qPCR MasterMix plus for SYBR® green I
0,75 µl/ 1,25 µl Primer A (300nM/500nM)
0,75 µl/ 1,25 µl Primer B (300nM/500nM)
5 µl genomisch DNA of cDNA, verschillende verdunningen
Aanvullen tot 25 µl met MilliQ water
- Elke oplossing wordt in het drievoud gemaakt in een ‘96 well’-microtiterplaat. Als negatieve
controle worden er oplossingen gemaakt zonder DNA.
- Voer de microtiterplaat in de ABI7000, voer PCR uit en analyseer de gegevens.
13. Micro-array hybridisatie-analyse.
De analyse van de hybridisatie van RNA van STC-1 cellen aan de Micro-Array werden uitgevoerd door de Micro-Array experts van het VIB onder leiding van Dr. Van Hummelen. Twee GeneChip Mouse Genome 430 2.0 Arrays werden besteld bij Affymetrix. Deze micro-arrays bevatten ongeveer 100 oligonucleotiden die een weesreceptor-cDNA vertegenwoordigen. De ene Array werd blootgesteld aan RNA van STC-1 cellen opgekweekt met 5 mM glucose, de andere aan RNA van STC-1 cellen opgekweekt met 25 mM glucose. Gegevens over de fluorescentie van elk van de 45101 spots op de array en de vergelijking tussen het signaal op de beide micro-arrays werden ons overhandigd in de vorm van een Excel-bestand.
Het onderzoeksobject van dit thesisonderzoek is het RNA van verschillende celtypes. Dit werd uit epitheelcellen van de dunne darm van muizen geďsoleerd aan de Universiteit van Liverpool. Ook uit STC-1 cellen werd RNA geďsoleerd, deze entero-endocriene cellijn is een beproefd in vitro modelsysteem voor de werking van het epitheel van de dunne darm. Enerzijds werd RNA geďsoleerd uit cellen in cultuur die 5 mM glucose bevat, en anderzijds uit een celcultuur met 25 mM glucose. De mengsels zijn vrij van DNA en RNase. De PCR reacties gaan telkens uit van cDNA, de gebruikte PCR-technieken zijn in feite allen variaties op Reverse Transcriptase PCR (RT-PCR). De RT reactie gebeurde telkens met 2 µg RNA en werd verdund tot 80 µl met water.
1. DOP-PCR (Degenerate Oligonucleotide Primed PCR)
DOP-PCR werd uitgevoerd met gedegenereerde primerparen die in andere weefsels tot de ontdekking van GPCR’s hebben geleid. Uit de literatuur haalden we 17 primers die op een geconserveerde nucleotidesequentie van GPCR’s zijn gebaseerd en voor een deel van een transmembraan-α-helix coderen (Tabel1.) PCR werd uitgevoerd aan de hand van het temperatuurprogramma dat in het artikel opgegeven was. Als positieve controle gebruikten we primers voor GAPDH-mRNA. Het PCR product werd telkens op een 1,5 % agarosegel geplaatst en agarosegelelectroforese werd toegepast. DOP-PCR leverde in drie gevallen één of twee PCR producten op.
De PCR producten werden opgezuiverd en in de vector pCR 2.1 gekloneerd. Competente E. coli cellen werden met deze vector getransformeerd en opgekweekt in LB-medium. De cellen werden uitgeplaat op een LB-agarosegel met Ampicilline, X-gal en IPTG. Na kleurontwikkeling werden van elke plaat tien witte kolonies geselecteerd en weer opgekweekt op LB-medium met Ampicilline. Het plasmide werd afgezonderd uit de E. coli cellen (miniprep). Door restrictiesplitsing met EcoRI werd de aanwezigheid van een insert in het plasmide gecontroleerd. Daarna werd van de goede plasmidemengsels de concentratie bepaald en een goede verdunning gemaakt om met vector-specifieke primers de sequentie te bepalen.
De verkregen nucleotidensequenties werden vertaald naar aminozuursequenties. In één geval codeerde de gecloneerde sequentie voor actine, in de twee andere gevallen codeerde de gecloneerde sequentie niet voor een proteďne.
|
Primernr |
Sequentie |
Bron |
Gebaseerd op |
|
|
3651 |
GGGAATTCGKIRYITTYIYIHTITGYTGGIYICC |
Tensen et al., 1994 |
TM6 |
|
|
3652 |
CCGGATCCTTIARRMAISIRTADAWDABIGGRT |
|
TM7 |
|
|
3655 |
CCGGATCCGYSATYRSSITKGACMGSTA |
Libert et al., 1989 |
TM3 |
|
|
3656 |
ACGAATTCGGSMICCARCAGAISRYRAA |
|
TM6 |
|
|
4280 |
CGGATCCTGTGYGYSATYGCIITKGAYMGSTAC |
Wilkie et al., 1993 |
|
|
|
4281 |
GGAATTCAARWAGGGCAGCCAGCAGAISRYGAA |
|
|
|
|
4282 |
CGGATCCTIACIGYIAGIACIYGARMGITGG |
Wilkie et al., 1993 |
|
|
|
4283 |
GGAATTCGCRWARGAIATIGGIGCCAGRCA |
|
|
|
|
4260 |
TGGGAHHSTGGCCVTTYGG |
O'Dowd et al., 1997 |
TM2 |
GPR7 GPR8 |
|
4261 |
TGGGAHHSTGGCCVTTYGG |
|
TM3 |
|
|
4262 |
GTSATGAGYGYVGACCGMTA |
O'Dowd et al., 1997 |
TM3 |
GPR7 GPR8 |
|
4263 |
GGGGTTSAGGCASSWGTT |
|
TM7 |
|
|
4256 |
CTCAAYYTRGCSATWGCSGA |
O'Dowd et al., 1996 |
TM2 |
GPR1 GPRC5A |
|
4257 |
TAAAGSATGGGGTTCAWGCARCWRTT |
|
TM7 |
|
|
4258 |
ATCYTCAACCTKGCYMTSGCMGA |
Marchese et al., 1998 |
TM2 |
GPR7 GPR8 |
|
4259 |
CAGGAAGGCGTARAGRAMKGGRTT |
|
TM7 |
|
|
4519 |
NYTNDSNTAYWTHRKNAYNTGGBTN |
Stolz en Paulussen |
TM6 |
|
|
4517 |
YTGNAVRTYNGCNADNADNGGNAM |
|
TM6 |
|
|
4520 |
GYTNGCNTAYATHGGNATHTGGYTN |
|
TM6 |
|
|
4521 |
YTGNARRTTNGCDATDATNGGRAA |
|
TM6 |
|
|
4518 |
YTGNARRTTNGCDATDATNGGRAA |
|
TM2 |
|
|
4523 |
NARCCADATNCCDATRTANGCNARC |
|
TM2 |
|
|
4514 |
MYDAWRTANSHNARNRKNKMDAWNRWNADNS |
|
TM6 |
|
|
4524 |
TTYBKNHTNATHTGYBWNKKNYTN |
|
TM2 |
|
|
4516 |
NAVCCANRTNMYDAWRTANSHNARN |
|
TM6 |
|
|
4515 |
CCDATRTANGCNARCATNGCDATRAADATNG |
|
TM6 |
|
|
4264 |
TAGTCGACTWYATISTIAAYYTIGCIBTIGCIGAYYT |
Takada et al.,1997 |
TM2 |
|
|
4265 |
TGGAATTCTTRYTIAARAAISCRTAIATIAVIGGRT |
|
TM7 |
|
|
4266 |
TTYAARCARYTNCAYWSNCCNAC |
Borowsky et al., 2001 |
TM2 |
GPR57, TA1 |
|
4268 |
ATNCCNARNGTYTTNRCNGCYTT |
|
TM4 |
GPR58 |
|
4267 |
GARHVNTGYTGGTAYTTYGG |
Borowsky et al., 2001 |
TM2 |
TA3, TA1, |
|
4269 |
CCRAARWACCARCANBNYTCNRY |
|
TM4 |
GPR58, PNR |
|
4284 |
ATNGGNTGGGGNKTNCCNAT |
Liu et al., 1999 |
TM4 |
Secretin-like |
|
4285 |
ACNRANACNAARAANCCYTGRAA |
|
TM7 |
Receptors |
|
4286 |
AAYTRSATIMTISTITIAAYYTIGCIGTIGCIGA |
Buck en Axel, 1991 |
TM2 |
|
|
4291 |
CTGIYKRTTCATIAWIMMRTAIAYIAYIGGRTT |
|
TM7 |
|
|
4287 |
AAYTAYTTYMTIATIWCICTIGCIYTIGCIGA |
Buck en Axel, 1991 |
TM2 |
|
|
4292 |
KRTSRTTIAGRCARCARTAIATIATIGGRTT |
|
TM7 |
|
|
4288 |
AAYYWITTYMTIATIWCICTIGCITSIGCIGA |
Buck en Axel, 1991 |
TM2 |
|
|
4293 |
TCIATRTTRAAIGTIGTRTAIATIATIGGRTT |
|
TM7 |
|
|
4289 |
MGITTIYTIATGTGYAAYCTIWSYTTYGCIGA |
Buck en Axel, 1991 |
TM2 |
|
|
4294 |
GCYTTIGTRAAIATIGCRTAIAGRAAIGGRTT |
|
TM7 |
|
|
4290 |
ACIGTITAYATIACICAYYTIWSIATIGCIGA |
Buck en Axel, 1991 |
TM2 |
|
|
4295 |
AARTCIGGRSWICGISARTAIATSAIIGGRTT |
|
TM7 |
|
Tabel1: gedegenereerde primers. De sequenties zijn gedegenereerd, symbolen: R = A en G;
Y = C en T; M = A en C; K = G en T; S = G en C; W = A en T; H = A en T en C;
B = G en T en C; D = G en A en T; V = G en A en C; N = A en G en C en T; I = inosine
Met DOP-PCR moeten er veel PCR reacties uitgevoerd worden om één PCR product te verkrijgen. Dan moet men nog alle cloneringsstappen doorlopen waarna de sequentiebepaling van het insert in de vector vaak een dubbelzinnig resultaat oplevert dat teveel N’s bevat om te kunnen interpreteren. DOP-PCR is een geschikte techniek om nieuwe genen te ontdekken op basis van de homologie met gekende receptors. Om meer resultaten te bekomen, hebben we vervolgens de expressie van gekende receptorgenen bepaald in darmepitheelcellen en STC-1 cellen.
2. RT-PCR (Reverse Transcriptase PCR)
In een organisme waarvan het genoom gekend is, kan men de expressie van gekende genen heel specifiek met RT-PCR achterhalen. De eerste GPCR die we hebben aangetoond in de muizendarm is GPR35. O ‘Dowd et al. (1997) hadden deze receptor aangetoond in de rattendarm door middel van DOP-PCR. Omdat dit ons niet lukte voor het muis RNA met dezelfde primers en hetzelfde temperatuurprogramma werden specifieke primers ontworpen op basis van de gekende sequentie van het GPR35 mRNA van de muis. RT-PCR leverde een product met de juiste lengte, zowel in het RNA dat uit muizendarmepitheelcellen was geďsoleerd, als in het STC-1 RNA.
Onderzoek naar de expressie van receptoren m.b.v. RT-PCR werd reeds door verschillende onderzoeksgroepen op grote schaal toegepast. Vassilatis et al. (2003) onderzochten de expressie van 100 receptoren (vooral orphan GPCR’s) in 26 weefsels van de muis, in de darm werd de aanwezigheid van 32 GPCR’s aangetoond, waaronder ook GPR35. In eerste instantie hebben we primers ontworpen gebaseerd op de mRNA sequentie van tien van de weesreceptoren (tabel X), met een voorkeur voor weesreceptoren die weinig homologie hebben met receptoren met een specifieke, reeds gekende liganden. Met de bedoeling om zoveel mogelijk van de coderende sequentie van het gen te kunnen bepalen, werden primers gekozen die ver uiteen liggen op het cDNA.
|
gen |
primernr |
sequentie |
Lengte amplicon |
|
GPR35 |
4790 |
ATGAATAGTACAACCTGTAACAGCACCCTCACGT |
921 |
|
|
4791 |
GGTGAGGCTCAGGATCTGGGAATCTTG |
|
|
GPR151 |
4884 |
TGGGAAAGGCAATGCTGAGAGC |
845 |
|
|
4885 |
CCAGCCTTCACATGCCATACCC |
|
|
GPR73 |
4886 |
AATAACACAGACACCTTCACCGACTTC |
1113 |
|
|
4887 |
TATTCCCGTGGTCCTGAGGTCG |
|
|
RDC1 |
4888 |
AGCCTGGCAACTACTCTGACATCAACTG |
1033 |
|
|
4889 |
GTACTCTGTCTCTGACACTCTGGAGGCATC |
|
|
GPR43 |
4890 |
CCCAGACTGGCACAGTTCCTTG |
987 |
|
|
4891 |
CTACTCGGTGACAAATTCAGAACTCTGTAC |
|
|
TEM5 |
4892 |
GCTGCTGCCTTGTCTTCTGCTC |
1896 |
|
|
4893 |
CCATTTCTGAAGACCAGCAGTTGC |
|
|
GPRC5C |
4896 |
ATGGCCACTCACAGAACCTTGCTG |
1173 |
|
|
4897 |
GTGGGAGGATGACGTCGTATGCAC |
|
|
TPRA40 |
4898 |
AGGAGGCCAATGGAAGCACAGC |
1096 |
|
|
4899 |
TCAGGCATTGATGGCTTTCCAGC |
|
|
AGTRL1 |
4900 |
ATGGAAGATGATGGTTACAACTACTATGGG |
1100 |
|
|
4901 |
CGATTTCTCATGCATCTGCTCTCC |
|
|
PGR22 |
4902 |
TCCTTGTGGGCGTGCTTCTG |
538 |
|
|
4903 |
GAGATTAGCAAAGAGGCCGATGATAAG |
|
|
GPR55 |
4904 |
AAGGCAGCAGTTGATGTTGGAGAAAC |
1098 |
|
|
4905 |
CTCTCTGTAAGCCGCTCATGTGACTG |
|
Tabel 2: Specifieke primers voor amplificatie van GPCR’s, verwachte lengte van het amplicon in baseparen
We hebben van acht GPCR’s aangetoond dat ze in de muizendarm en in de STC-1 cellen tot expressie komen: GPR35, GPR151, RDC1, GPR43, GPRC5C, TPRA40, AGTRL1 en PGR22. Eén receptor komt alleen in de STC-1 cellen voor: TEM5, het is dan ook een ‘tumor endothelial marker’ en de STC-1 cellen zijn kankercellen. Behalve GPR43 en AGTRL1, zijn dit allemaal receptoren waarvan het ligand niet gekend is. Voor GPR73 en GPR55 konden we de expressie niet aantonen, in tegenstelling tot de gegevens in het artikel van Vassilatis et al. (2003)
Fig.1: RT-PCR producten bekomen met RNA van het muizendarmepitheel (boven) en RNA van de STC-1 cellen gekweekt op 25 mM glucose (onder), met de primers uit tabel 2.
3. Q-PCR (Quantitative real-time PCR)
Voor de quantificatie van het cDNA van de acht aangetoonde weesreceptoren en SGLT1 werden Q-PCR primers ontworpen. Voor de referentie genen GAPDH en Actine waren al Q-PCR primers aanwezig in het labo. De Q-PCR experimenten hebben als doel de mRNA’s aanwezig in de STC-1 cellen te quantificeren en de expressie te vergelijken bij verschillende concentraties aan glucose.
|
gen |
primernr |
sequentie |
Lengte amplicon |
|
GPR151 |
4938 |
TGGCACGAGAGGGATGCT |
64 |
|
|
4939 |
CTTCGTGTTCCCAGGGTATAGG |
|
|
TEM5 |
4940 |
GGCGTCCTCCTGAATGACTCT |
97 |
|
|
4941 |
GAGAATATACGCCATCACCATCCT |
|
|
RDC1 |
4942 |
CTCCATCTTACACTACATCCCGTTTA |
132 |
|
|
4943 |
TTGCGGTTGATGAAGCTGTAGA |
|
|
TPRA40 |
4944 |
ACTACTCCAGCACACAGTTTGACTCT |
102 |
|
|
4945 |
GCTCGCTGTCTGTGCTGTTG |
|
|
PGR22 |
4946 |
CCAAGACTTTGCCTACAGCAGTAA |
99 |
|
|
4947 |
AGCATTCCAGTAAGGCTGGAAA |
|
|
AGTRL1 |
4948 |
TCAGAGCGGGTGCAAAGG |
73 |
|
|
4949 |
GCTGTGCCCGGAAGAATAACT |
|
|
GPR35 |
4952 |
CTGGATGCCATCTGTTACTACTACATG |
87 |
|
|
4953 |
CTGGGAATCTTGGCTCTTGTG |
|
|
GPRC5C |
4954 |
CTTGTGTGGCCGCTTCAAG |
61 |
|
|
4955 |
GACAGTGGTGAGCAACACAAAGA |
|
|
SGLT1 |
4950 |
CATTCCAGACGTGCACCTGTAC |
152 |
|
|
4951 |
TCCAGGTCGATTCGCTCTTC |
|
|
actine |
3745 |
TCCTCCTGAGCGCAAGTACTCT |
104 |
|
|
3746 |
CGGACTCATCGTACTCCTGCTT |
|
|
GAPDH |
3747 |
ATGTGTCCGTCGTGGATCTGA |
81 |
|
|
3748 |
ATGCCTGCTTCACCACCTTCT |
|
Tabel 3: Q-PCR primers, verwachte lengte van het amplicon in baseparen
De primers werden getest en een
standaardcurve werd opgesteld met een verdunningsreeks van gekende concentraties
aan genomisch DNA.Voor alle primerparen was de efficientie goed (helling
standaardcurve ongeveer -3,2) behalve voor het primerpaar voor PGR22, waar de Ct
al erg hoog was bij kleine concentraties. Analyse van de dissociatiekinetiek
toonde aan dat de primers voor PGR22 door binding met elkaar een initiatieplaats
voor het polymerase vormen waardoor deze niet bruikbaar zijn voor de
quantificatie van cDNA. Omdat de primers die voor SGLT1 ontworpen werden een
intron omvatten, werd hiervoor een verdunningsreeks gemaakt van het cDNA. De
standaardcurve laat toe de onderlinge verhouding van de cDNA’s van de
verschillende receptoren in het mengsel te bepalen. Doordat de RT-reactie echter
niet voor alle RNA’s even efficiënt verloopt, is de concentratie van het cDNA
niet gelijk te stellen aan de concentratie van het mRNA en de absolute data
dienen enkel als een indicatie voor de mate waarin het gen tot expressie komt.
Met behulp van de standaardcurve voor elk gen, kunnen we de bekomen Ct-waarden
omzetten naar C0 waarden in ng. Dit gebeurt aan de hand van de
volgende vergelijking: log10 (C0)
= ![]() , met A de waarde van Ct bij de amplificatie van 1
ng genomisch DNA en B de helling van de standaardcurve. De C0 geeft
dus aan hoeveel cDNA oorspronkelijk in het mengsel aanwezig was, uitgedrukt in
het aantal ng genomisch DNA dat dezelfde Ct geeft bij amplificatie met dezelfde
primers.
, met A de waarde van Ct bij de amplificatie van 1
ng genomisch DNA en B de helling van de standaardcurve. De C0 geeft
dus aan hoeveel cDNA oorspronkelijk in het mengsel aanwezig was, uitgedrukt in
het aantal ng genomisch DNA dat dezelfde Ct geeft bij amplificatie met dezelfde
primers.
|
Gen |
Intercept (A) |
Helling (B) |
R˛ |
|
actine |
26,473099 |
-3.289253 |
0,997436 |
|
GAPDH |
21,784220 |
-3,284852 |
0,996091 |
|
SGLT1 |
34,078209 |
-3,480001 |
0,993719 |
|
GPR151 |
28,239061 |
-3,100518 |
0,998548 |
|
AGTRL1 |
28,948137 |
-3,219751 |
0,997839 |
|
GPR35 |
27,696144 |
-3,146134 |
0,995632 |
|
GPRC5C |
27,540588 |
-2,976853 |
0,994532 |
|
TEM5 |
28,475891 |
-3,203583 |
0,998851 |
|
RDC1 |
28,773718 |
-3,362955 |
0,999259 |
|
TPRA40 |
27,998741 |
-2,991432 |
0,998070 |
|
PGR22 |
36,292927 |
-0,645684 |
0,369492 |
Tabel 4: gegevens van de standaardcurves, gebaseerd op een verdunningsreeks van genomisch DNA.
Vergelijking van de expressie van hetzelfde gen in de twee condities door vergelijking met referentiegenen is zeer betrouwbaar, op voorwaarde dat de beide referentiegenen niet veranderen ten opzichte van elkaar bij de verschillende condities. De vergelijking van de C0 van de referentiegenen toont echter aan dat de verhouding van hun concentraties verschilt in de beide condities. De expressie van één van de twee referentiegenen verandert bij toevoegen van glucose, wat de interpretatie van de gegevens bemoeilijkt: vergelijking met het ene referentiegen levert andere resultaten dan vergelijking met het andere. Om juist te weten welk van de twee genen wel constant blijft, zou Q-PCR moeten uitgevoerd worden met een derde referentiegen. Omdat GAPDH (glyceraldehyde-3-fosfaat dehydrogenase) tussenkomt in de glycolyse, kunnen we aannemen dat dit gen sterker tot expressie komt in aanwezigheid van een hogere concentratie glucose. Analyse van micro-arrays wijst uit dat de expressie van GAPDH ook werkelijk hoger is bij een hogere glucoseconcentratie, en dat de expressie van actine gelijk blijft. De expressie van actine is dus een geschikte referentie om de andere genen mee te vergelijken. De gegevens worden genormaliseerd door van elk van de genen de C0 te delen door de C0 van actine.
Voor de vergelijking van de twee condities kan men de absolute verhoging en de relatieve verhoging in beschouwing nemen. De absolute verhoging van de expressie wordt bekomen door de genormaliseerde waarde bij 5 mM glucose af te trekken van de de genormaliseerde waarde bij 25 mM glucose. Deze waarde geeft aan wat het verschil is in expressie in de twee condities, uitgedrukt als de verhoging in cDNA concentratie gedeeld door de cDNA concentratie van actine. Als de expressie vermindert bij hogere glucoseconcentratie is dit getal negatief. De relatieve verhoging geeft aan hoeveel maal de expressie verhoogd is bij 25 mM glucose ten opzicht 5 mM glucose en wordt berekend door de genormaliseerde waarde bij 25 mM glucose te delen door de genormaliseerde waarde bij 5 mM glucose. Als de expressie verminderd is bij een hogere glucoseconcentratie is dit getal kleiner dan één.
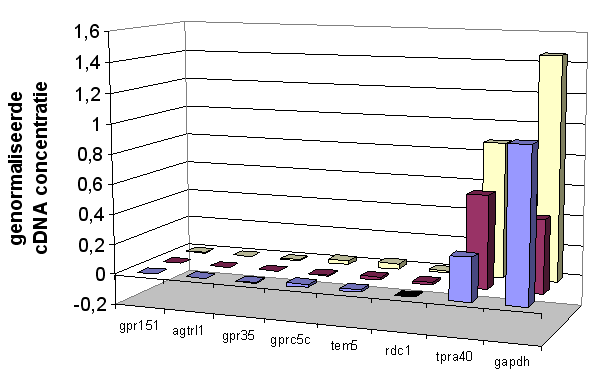
Fig. 2: Visualisatie van de concentraties van de verschillende cDNA’s in STC-1 cellen opgekweekt in 5 mM glucose (rood) en 25 mM glucose (geel) en het verschil tussen de twee (blauw), genormaliseerd ten opzichte van actine
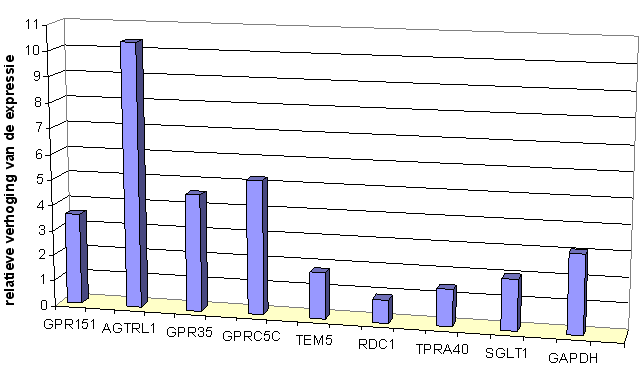
Fig. 3: Visualisatie van de relatieve verhoging van de expressie bij overgang van 5 mM naar 25 mM.
|
|
|
|
|
|
normalisatie |
Relatieve verhoging (25)/(5) |
|
|
cDNA |
<Ct> |
log10(C0) |
C0 |
C0/C0(actin 25) |
C0/C0(actin 5) |
||
|
GPR151 |
gpr151 5 |
34,42 |
-1,99352 |
0,01015 |
0,002632203 |
|
3,55469699 |
|
gpr151 25 |
32,66667 |
-1,42802 |
0,037323 |
|
0,000740486 |
||
|
AGTRL1 |
agtrl1 5 |
37,67667 |
-2,71093 |
0,001946 |
0,001470645 |
|
10,3611042 |
|
agtrl1 25 |
34,36 |
-1,68083 |
0,020853 |
|
0,000141939 |
||
|
GPR35 |
gpr35 5 |
33,29667 |
-1,78013 |
0,016591 |
0,005548481 |
|
4,58424231 |
|
gpr35 25 |
31,17 |
-1,10417 |
0,078674 |
|
0,001210338 |
||
|
GPRC5C |
gprc5c 5 |
30,92667 |
-1,13747 |
0,072867 |
0,027960675 |
|
5,2599536 |
|
gprc5c 25 |
28,73667 |
-0,40179 |
0,396467 |
|
0,005315765 |
||
|
TEM5 |
tem5 5 |
30,26333 |
-0,55795 |
0,276725 |
0,036384806 |
|
1,80233744 |
|
tem5 25 |
29,39667 |
-0,28742 |
0,515917 |
|
0,020187566 |
||
|
RDC1 |
rdc1 5 |
31 |
-0,662 |
0,21777 |
0,014082301 |
|
0,88642173 |
|
rdc1 25 |
31,12667 |
-0,69967 |
0,199679 |
|
0,015886683 |
||
|
TPRA40 |
tpra40 5 |
25,25333 |
0,917757 |
8,27479 |
0,884327635 |
|
1,46494471 |
|
tpra40 25 |
24,71333 |
1,098273 |
12,53928 |
|
0,603659394 |
||
|
SGLT1 |
sglt1 5 |
30,18333 |
1,119217 |
13,15882 |
1,925782265 |
|
2,00611303 |
|
sglt1 25 |
29,08 |
1,436267 |
27,30653 |
|
0,959957011 |
||
|
GAPDH |
gapdh 5 |
19,11667 |
0,812077 |
6,487497 |
1,46476458 |
|
3,09496465 |
|
gapdh 25 |
17,45667 |
1,317427 |
20,76955 |
|
0,473273444 |
||
|
ACTIN |
actin 5 |
22,73333 |
1,136965 |
13,70771 |
1 |
|
1 |
|
actin 25 |
22,685 |
1,151659 |
14,17945 |
1 |
|
||
Tabel 5: Analyse van de resultaten van Q-PCR met actine als referentiegen.
De resultaten wijzen uit dat de concentratie van SGLT1-mRNA ongeveer verdubbeld is in de STC-1 cellen die op 25 mM glucose werden opgekweekt ten opzichte van de STC-1 cellen die aan slechts 5 mM glucose werden blootgesteld, zoals al aangetoond was door Vayro et al. in 2001. De expressie van GAPDH neemt nog meer toe dan SGLT1. Het is in dus in deze experimenten niet bruikbaar als referentiegen.
Als de concentratie van één van de GPCR-RNA’s verminderd is bij hogere glucoseconcentratie dan kan dit een aanwijzing zijn dat glucose het ligand is dat de expressie van zijn eigen receptor verlaagt. We stellen echter vast dat de meeste receptorgenen sterker tot expressie komen bij hogere glucoseconcentratie. Van de 7 receptor mRNA’s waarvoor Q-PCR experimenten uitgevoerd zijn, was RDC1 de enige die in mindere concentratie aanwezig was bij 25 mM glucose. AGTRL1, GPRC5C, GPR35 en GPR151 vertonen een grote relatieve verhoging, de expressie van TPRA40 en TEM5 is minder sterk verhoogd. Als we nu ook de gegevens over de absolute concentraties bekijken, stellen we vast dat TPRA40 veel sterker tot expressie komt dan TEM5, RDC1 en GPRC5C. De receptoren die het minst tot expressie komen zijn AGTRL1, GPR151 en GPR35.
4. Analyse van hybridisatie van RNA aan oligonucleotiden op micro-arrays.
Om van nog meer orphan GPCR’s de expressie na te gaan in de STC-1 cellen werden twee micro-arrays onderworpen aan hybridisatie met STC-1 RNA uit de beide condities. De gegevens gegenereerd door de meting van fluorescentie van elk van de 45101 spots werden geanalyseerd door op de website van affymetrix (www.affymetrix.com) te zoeken naar orphan GPCR’s die op de gebruikte micro-array vertegenwoordigd zijn (zoektermen waren GPCR, GPR, TM7). Van de GPCR genen waarvoor geen specifiek ligand weergegeven was werd het overeenkomstige nummer gebruikt om de resultaten van hybridisatie-analyse te vinden. Als de aanwezigheid van het mRNA aangetoond werd in één of in beide stalen, werd op de site van het NCBI gezocht naar informatie over mogelijke functies of liganden (zie discussie). Ook werd naar de gegevens gezocht van de GPCR’s waarvan de expressie al aangetoond was met RT-PCR en naar de gegevens over SGLT1 en GAPDH.
De micro-array toont de expressie aan van 16 nieuwe weesreceptoren in de STC-1 cellijn (Tabel 6). Het signaal voor TM7SF1, GPR48, GPR22 en GPR49 is lager bij een hogere glucoseconcentratie. Van TM7SF2, TM7SF3, GPR85 en GPR120 verhoogt de expressie bij hogere glucoseconcentraties. Voor TPRA40 en GPRC5C worden de gegevens van Q-PCR bevestigd terwijl RDC1, TEM5 en AGTRL1 niet worden gedetecteerd.
Voor de 16 receptor-mRNAs en ook voor nog twee receptoren uit het artikel van Vassilatis (GPR125 en GPR80) werden Q-PCR primers ontworpen (Tabel 7). De primers zijn enkel gebruikt voor PCR op het cDNA van muizendarm en op cDNA van STC-1 cellen (5 mM glucose), gevolgd door 3% agarosegel-electroforese (Fig. 4), maar ze zijn klaar om gebruikt te worden in Q-PCR reacties.
|
gen |
Spot nr. |
5 mM Glucose |
25 mM glucose |
5→25 mM glucose |
|||
|
TPRA40 |
1460276_a_at |
127,6 |
P |
177 |
P |
0,4 |
I |
|
GPRC5C |
1452947_at |
17,6 |
P |
30,2 |
P |
0,9 |
I |
|
GPRC5C |
1424450_at |
5,7 |
A |
7,3 |
A |
0,5 |
NC |
|
RDC1 |
1417625_s_at |
15,6 |
A |
8,8 |
A |
-0,3 |
NC |
|
TEM5 |
1418379_s_at |
7,1 |
A |
8,2 |
A |
0,3 |
NC |
|
AGTRL1 |
1423037_at |
8,2 |
A |
14,4 |
A |
0,7 |
NC |
|
AGTRL1 |
1438651_a_at |
8 |
A |
8,4 |
A |
-0,7 |
NC |
|
GPR43 |
1425215_at |
37 |
P |
22,2 |
P |
-0,3 |
NC |
|
GPR43 |
1425216_at |
3,9 |
A |
2,9 |
A |
-0,4 |
NC |
|
TM7SF1 |
1419932_s_at |
14,2 |
P |
12,2 |
A |
0,1 |
NC |
|
TM7SF1 |
1423164_at |
33,8 |
A |
3,4 |
A |
-3,3 |
NC |
|
TM7SF1 |
1429775_a_at |
128,4 |
P |
112,1 |
P |
-0,2 |
NC |
|
TM7SF1 |
1439255_s_at |
184,2 |
P |
149,3 |
P |
-0,3 |
D |
|
TM7SF1 |
1439256_x_at |
95,5 |
P |
76,9 |
P |
-0,4 |
D |
|
TM7SF1 |
1441398_at |
18,2 |
A |
14,2 |
A |
-0,5 |
NC |
|
TM7SF1 |
1446806_at |
6,9 |
A |
3,9 |
A |
0,2 |
NC |
|
TM7SF1 |
1447686_at |
7,6 |
A |
8,6 |
A |
0,6 |
NC |
|
TM7SF1 |
1449670_x_at |
71,7 |
P |
64,3 |
P |
-0,4 |
D |
|
TM7SF1 |
1449671_at |
8,9 |
P |
6,5 |
A |
-0,4 |
NC |
|
TM7SF1 |
1450881_s_at |
104,7 |
P |
76,2 |
P |
-0,3 |
NC |
|
TM7SF1 |
1450882_s_at |
102,9 |
P |
89,5 |
P |
-0,2 |
NC |
|
TM7SF2 |
1460684_at |
45,1 |
P |
123,1 |
P |
1,4 |
I |
|
TM7SF3 |
1428098_a_at |
53,7 |
P |
81,9 |
P |
0,5 |
NC |
|
TM7SF3 |
1445392_at |
8,5 |
A |
1,1 |
A |
-1,9 |
NC |
|
TM7SF3 |
1452664_a_at |
136,2 |
P |
261,6 |
P |
0,6 |
I |
|
GPR48 |
1433891_at |
224,8 |
P |
153,4 |
P |
-0,5 |
D |
|
GPR48 |
1453765_at |
9,8 |
A |
9,1 |
A |
-0,2 |
NC |
|
GPR18 |
1439141_at |
16,9 |
P |
21,6 |
P |
0,3 |
NC |
|
GPR1 |
1460123_at |
19,4 |
P |
20,2 |
P |
-0,1 |
NC |
|
GPR56 |
1421118_a_at |
84 |
P |
83 |
P |
0,2 |
NC |
|
GPR19 |
1421756_a_at |
258,1 |
P |
280,1 |
P |
0,3 |
NC |
|
GPR19 |
1445480_at |
32,1 |
P |
41,1 |
P |
0,3 |
NC |
|
GPR85 |
1424896_at |
38,9 |
P |
65,9 |
P |
1 |
I |
|
GPR85 |
1424897_at |
13,5 |
P |
44 |
P |
1,5 |
I |
|
GPR85 |
1437618_x_at |
48,7 |
P |
84,2 |
P |
0,6 |
I |
|
GPR85 |
1459795_at |
8,5 |
A |
5 |
A |
-0,5 |
NC |
|
GPR39 |
1432260_at |
25,1 |
P |
29,6 |
P |
0,1 |
NC |
|
GPR61 |
1436972_at |
13,1 |
P |
14 |
P |
0 |
NC |
|
GPR88 |
1423171_at |
0,3 |
A |
4,3 |
A |
4,6 |
NC |
|
GPR120 |
1439489_at |
100,4 |
P |
183,1 |
P |
0,8 |
I |
|
GPR22 |
1434672_at |
129,6 |
P |
103,7 |
P |
-0,4 |
D |
|
GPR22 |
1434673_at |
101,5 |
P |
72,5 |
P |
-0,5 |
D |
|
GPR49 |
1450988_at |
93 |
P |
76,9 |
P |
-0,5 |
D |
|
SGLT1 |
1419057_at |
25,8 |
P |
31,3 |
P |
0,4 |
NC |
|
SGLT1 |
1455431_at |
18,9 |
P |
15,2 |
P |
0,3 |
NC |
|
GAPDH |
M32599_5_at |
3821,6 |
P |
4857,3 |
P |
0,4 |
I |
|
GAPDH |
M32599_M_at |
3666,6 |
P |
4855,9 |
P |
0,4 |
I |
|
GAPDH |
M32599_3_at |
2992,4 |
P |
4157 |
P |
0,5 |
I |
|
GAPDH |
1418625_s_at |
3184,8 |
P |
4443,4 |
P |
0,5 |
I |
Tabel 6: De gegevens afkomstig van micro-array-analyse. P = aanwezig, A = afwezig, NC = niet veranderd, I = verhoogd, D = verlaagd.
|
Gen |
Primernr. |
sequentie |
Lengte amplicon |
|
GPR125 |
5021 |
CGTGCAGTTTCGAACAAACG |
69 |
|
|
5022 |
CTGGCCCGGTGTCCTTT |
|
|
GPR88 |
5023 |
GCTCTACACGTGGAGGAACGA |
122 |
|
|
5024 |
GTTGCGCCTGGGACATG |
|
|
GPR18 |
5025 |
GGAGAAGTCCATACGGATCATCA |
67 |
|
|
5026 |
GTGGAAGGGCACGAAGCA |
|
|
TM7SF2 |
5027 |
GCAGCAGTGCCTCCAAAAGT |
72 |
|
|
5028 |
GGTAAGGCACACGCTTGCA |
|
|
GPR22 |
5029 |
TCGTGTTTGGTGTGAGAACTTCA |
70 |
|
|
5030 |
TCCCGGTGGCGTTTCA |
|
|
GPR120 |
5031 |
TCCGAGTGTCCCAACAAGACTA |
85 |
|
|
5032 |
ATGATGGGACTCCACATGATG |
|
|
GPR49 |
5033 |
TGAGATCAAAACACGCGAGTCT |
102 |
|
|
5034 |
TGCTGGCGTGGGTAAAGG |
|
|
TM7SF3 |
5050 |
GAAAGAGGACAGCCGCCTTT |
78 |
|
|
5051 |
GATGTTGGTCACTCTGCGTTCTC |
|
|
TM7SF1 |
5052 |
CCCCCGAAGATATGACAGTGAT |
75 |
|
|
5053 |
GGAGCAAAACTTCCCTGAAGTC |
|
|
GPR48 |
5054 |
AAGACGACTGGAAGCTCCTGAA |
79 |
|
|
5055 |
CCGCCTTGGCTGCTGAT |
|
|
GPR1 |
5056 |
TGGACCCCTTATCACCTGTTTAG |
76 |
|
|
5057 |
CCTGCAGCACATTCTGGAAA |
|
|
GPR19 |
5058 |
CTACCGCAGCAATGCCTACA |
76 |
|
|
5059 |
GATTTCCGAAATGCCCACAT |
|
|
GPR61 |
5060 |
AACCTGGATTGGCTACTTTTGC |
80 |
|
|
5061 |
TAAGCTCGCCCCGGATCT |
|
|
GPR40 |
5062 |
TGCCTCCAATGTGGCTAGTTT |
73 |
|
|
5063 |
CCCTGTGATGAGTCCCAACTTC |
|
|
GPR80 |
5064 |
CCTTTGGCAACCTGCTGTTATAT |
85 |
|
|
5065 |
CCGCTGGCTTTGCATCTC |
|
|
GPR39 |
5066 |
CCCATGGAGTTCTACAGCATCAT |
75 |
|
|
5067 |
CGTGTGGAGCTTACAGGACAGA |
|
|
GPR56 |
5068 |
CCAAGGCTTCCTCATCTTCCT |
90 |
|
|
5069 |
GCGCTGTCTGAGTTGTTCTTCA |
|
|
GPR85 |
5070 |
TTGCACGAGGGCCTGTAGTAC |
73 |
|
|
5071 |
ATTCCTGCTTGGGCGAAACT |
|
|
|
|
|
|
Tabel 7: Q-PCR primers en de verwachte lengte van het amplicon in baseparen
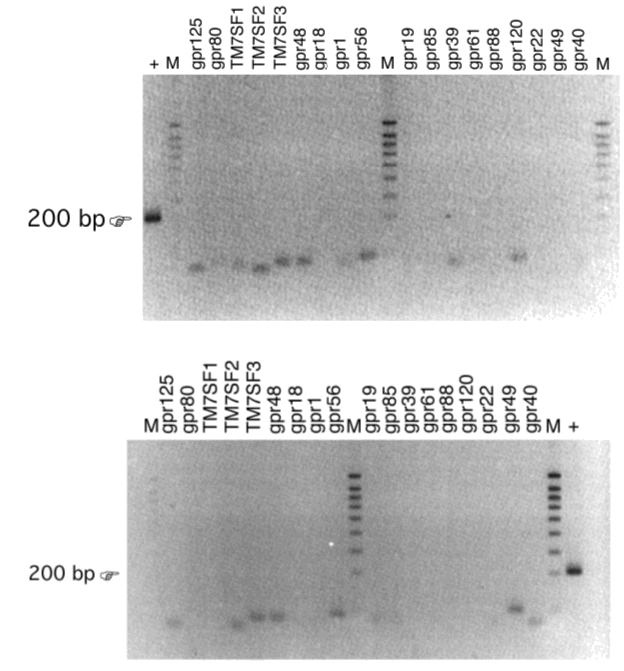
Fig. 4: Resultaten van PCR met Q-PCR primers op cDNA van muizendarmepitheelcellen (boven) en op cDNA van STC-1 cellen (5 mM glucose) (onder) gevolgd door agarosegelelectroforese. Niet alle bandjes zijn zichtbaar op de foto’s, zie tabel 8.
We tonen hiermee de aanwezigheid aan van veertien mRNA’s van GPCR’s in een RNA-extract van muizendarmepitheelcellen. Bij GPR19 en GPR56 is geen enkel bandje te zien op de foto, hoewel ze wel met het blote oog zichtbaar waren op de beide gels. Zes van de veertien GPCR’s worden niet gedetecteerd in het RNA-extract van STC-1 cellen gekweekt op 5 mM glucose, hoewel het micro-array-experiment aangaf dat ze er wel tot expressie komen. Eén GPCR wordt enkel in de STC-1 cellen gedetecteerd. Van drie GPCR’s konden we de expressie in geen van beide celtypes detecteren, hoewel deze door de micro-array wel werden gedetecteerd in het STC-1 RNA.
De resultaten van de micro-array, RT-PCR en Q-PCR worden samengevat in Tabel 8. Voor twintig GPCR-genen konden nog geen Q-PCR experimenten worden uitgevoerd. Dit komt doordat voor Q-PCR experimenten telkens een relatief grote hoeveelheid RNA noodzakelijk is. Het STC-1 RNA (25 mM glucose) was opgebruikt en er kon niet meer tijdig nieuw RNA aangemaakt en opgestuurd worden. Dit is ook de verklaring waarom de laatste 18 RT-PCR reacties op STC-1 RNA (5 mM glucose) werden uitgevoerd en niet op RNA (25 mM glucose), zoals voor de eerste 11 receptoren.
16 van de 29 onderzochte GPCR-RNA’s zijn aangetoond in zowel de muizendarmepitheelcellen als in de STC-1 cellen: TPRA40, GPR35, GPRC5C, GPR151, RDC1, AGTRL1, PGR22, GPR43, GPR125, TM7SF2, TM7SF3, GPR48, GPR56, GPR19, GPR85 en GPR40. Zes receptoren werden aangetoond in de muizendarmepitheelcellen, maar werden niet gedetecteerd met PCR op cDNA van STC-1 cellen (5 mM glucose) hoewel ze er wel aangetoond zijn met micro-array-analyse: GPR80, TM7SF1, GPR1, GPR39, GPR61 en GPR120. We hebben dus de expressie van 21 GPCR’s aangetoond in het muizendarmepitheel met RT-PCR. Van twee receptoren konden we enkel de expressie aantonen in STC-1 cellen: TEM5 en GPR49. Drie receptoren die door RT-PCR en Q-PCR in de STC-1 cellen (25 mM glucose) werden aangetoond, werden niet op de micro-array gedetecteerd: RDC1, AGTRL1 en TEM5.
Voor vijf receptoren konden we geen expressie aantonen aan de hand van RT-PCR, hoewel drie van deze receptoren wel gedetecteerd waren op de micro-array: GPR18, GPR88 en GPR22. Verder konden we ook twee receptoren die volgens Vassilatis et al. (2003) tot expressie komen in de darm, niet aantonen met RT-PCR: GPR73 en GPR55.
Door de quantitatieve benadering tonen we aan dat de hoeveelheid SGLT1 RNA ongeveer dubbel zo groot is in STC-1 cellen die aan 25 mM glucose blootgesteld werden ten opzichte van cellen die slechts 5 mM glucose kregen. De expressie van GAPDH is er driemaal hoger.
Van de zeven receptor-mRNA’s waar we quantitatieve informatie van hebben, is RDC1 de enige waarvan de expressie verminderd is bij de hogere glucoseconcentratie (met ongeveer 11%), de andere GPCR’s komen sterker tot expressie bij hogere glucoseconcentratie. TPRA40 komt duidelijk veel sterker tot expressie dan GPRC5C, RDC1 en TEM5. AGTRL1, GPR151 en GPR35 komen slechts zwak tot expressie, maar stijgen procentueel het meest.
De micro-array leverde ook gegevens over het verschil tussen de twee glucosecondities voor het RNA uit STC-1 cellen. Van vier receptoren neemt de expressie af bij hogere glucoseconcentraties: TM7SF1, GPR48, GPR22 en GPR49. Van zes GPCR-RNA’s is het signaal significant hoger bij de hoge glucoseconcentratie: TPRA40, GPRC5C, TM7SF2, TM7SF3, GPR85 en GPR120.
|
|
|
Microarray (STC-1 RNA) |
RT-PCR |
Q-PCR (STC-1 RNA) |
|||||
|
Muis RNA |
STC1 RNA |
cDNA/cDNAactin |
Relatieve verhoging |
||||||
|
|
|
5 |
25 |
Δ |
5 mM glucose |
25mM glucose |
|||
|
|
|
|
|
|
|
5 25 |
|
|
|
|
TPRA40 |
Vas |
P |
P |
I |
+ |
+ |
0,603659 |
0,884328 |
1,464945 |
|
GPR35 |
Vas |
|
|
|
+ |
+ |
0,00121 |
0,005548 |
4,584242 |
|
GPRC5C |
Vas |
P |
P |
I |
+ |
+ |
0,005316 |
0,027961 |
5,259954 |
|
GPR151 |
Vas |
|
|
|
+ |
+ |
0,00074 |
0,002632 |
3,554697 |
|
RDC1 |
Vas |
A |
A |
- |
+ |
+ |
0,015887 |
0,014082 |
0,886422 |
|
TEM5 |
Vas |
A |
A |
- |
- |
+ |
0,020188 |
0,036385 |
1,802337 |
|
AGTRL1 |
Vas |
A |
A |
- |
+ |
+ |
0,000142 |
0,001471 |
10,3611 |
|
PGR22 |
Vas |
|
|
|
+ |
+ |
|
|
|
|
GPR43 |
Vas |
P |
P |
NC |
+ |
+ |
|
|
|
|
GPR73 |
Vas |
A |
A |
- |
- |
- |
|
|
|
|
GPR55 |
Vas |
|
|
|
- |
- |
|
|
|
|
GPR125 |
Vas |
|
|
|
+ |
+ |
|
|
|
|
GPR80 |
Vas |
|
|
|
+ |
- |
|
|
|
|
TM7SF1 |
Vas |
P |
P |
D |
+ |
- |
|
|
|
|
TM7SF2 |
|
P |
P |
I |
+ |
+ |
|
|
|
|
TM7SF3 |
Vas |
P |
P |
I |
+ |
+ |
|
|
|
|
GPR48 |
Vas |
P |
P |
D |
+ |
+ |
|
|
|
|
GPR18 |
Vas |
P |
P |
NC |
- |
- |
|
|
|
|
GPR1 |
|
P |
P |
NC |
+ |
- |
|
|
|
|
GPR56 |
|
P |
P |
NC |
+ |
+ |
|
|
|
|
GPR19 |
|
P |
P |
NC |
+ |
+ |
|
|
|
|
GPR85 |
|
P |
P |
I |
+ |
+ |
|
|
|
|
GPR39 |
|
P |
P |
NC |
+ |
- |
|
|
|
|
GPR61 |
|
P |
P |
NC |
+ |
- |
|
|
|
|
GPR88 |
|
P |
P |
NC |
- |
- |
|
|
|
|
GPR120 |
|
P |
P |
I |
+ |
- |
|
|
|
|
GPR22 |
|
P |
P |
D |
- |
- |
|
|
|
|
GPR49 |
|
P |
P |
D |
- |
+ |
|
|
|
|
GPR40 |
|
|
|
|
+ |
+ |
|
|
|
|
SGLT1 |
|
P |
P |
NC |
|
|
|
|
2,006113 |
|
GAPDH |
|
P |
P |
I |
|
|
0,473273 |
1,464765 |
3,094965 |
Tabel 8: Samenvatting van de resultaten bekomen door micro-array analyse, RT-PCR en Q-PCR. In de tweede kolom staat aangegeven of de expressie van het gen in de dunne darm al werd aangetoond door Vassilatis et al., 2003 (Vas). De resultaten van de detectie aan de hand van micro-array hybridisatie van RNA’s uit STC-1 cellen (opgekweekt op 5 mM glucose (5) en 25 mM glucose (25)) P = aanwezig, A = afwezig, en over de verandering bij overgang van 5 naar 25 mM glucose: I = verhoogd, D = verlaagd, NC = geen verandering. De resultaten van RT-PCR gevolgd door gelelectroforese zijn weergegeven met ‘+’ als een bandje met de juiste lengte werd gedetecteerd en met ‘-’ als dit niet het geval was. In de kolom van het STC-1 RNA, zijn de eerste 11 gegevens afkomstig PCR op RNA uit cellen die op 25 mM glucose zijn gegroeid, de 18 laatste gegevens van cellen die op 5 mM glucose zijn gegroeid. Voor Q-PCR is de verhouding van de cDNA concentratie van het gen met de actine-cDNA concentratie weergegeven alsook de relatieve verhoging van de expressie bij overgang van 5 naar 25 mM glucose.
5. Voorbereiden van een restrictiefragment voor klonering in een expressievector.
Om de volledige coderende sequentie in de juiste richting in een expressievector in te kunnen brengen, maken we een PCR-product aan met aan beide zijden een verschillende restrictieknipplaats die niet in het amplicon voorkomt en die oneven uiteinden vormt bij restrictie. Hiervoor werden speciale primers ontworpen. De primer die het startcodon en de regio errond bevat, heeft een 5’ afhangend gedeelte dat een restrictieplaats voor HindIII bevat. De primer die bindt aan de regio rond het stopcodon, heeft een 5’ afhangend gedeelte met een restrictiplaats voor XhoI. (Tabel 9) Door PCR uit te voeren op het muizendarm cDNA met deze primers, krijgen we amplificatie van de volledige coderende sequentie, geflankeerd door unieke restrictieplaatsen en geschikt voor directioneel kloneren in een expressievector die na de promotersequentie een HindIII en een XhoI restrictieplaats bevat, in deze volgorde (zoals pYX 212) Deze aanpak lukte nog niet voor GPR43, AGTRL1 en TEM5, voor de meeste GPCR’s moet dit soort primers nog worden ontworpen.
|
Gen |
Primernr. |
Sequentie |
Lengte amplicon |
|
GPRC5C |
4920 |
GCGCaagcttATGGCCACTCACAGAACCTT |
1343 |
|
|
4921 |
TAGActcgagTTAGTCCCACACGTAGG |
|
|
TEM5 |
4922 |
GCGCaagcttATGCCGGTGCCTCCCGCGCGT |
4010 |
|
|
4923 |
TAGActcgagCTAGACGGTGGTCTCGCTTTTCCAGAGGCCAGTCTTCAT |
|
|
GPR35 |
4924 |
GCGCaagcttATGAATAGTACAACCTGTAACAGCACCCTC |
924 |
|
|
4925 |
TAGActcgagCTAGGTGAGGCTCAGGATCTGGGAATC |
|
|
GPR43 |
4926 |
GCGCaagcttATGACCCCAGACTGGCACAG |
1013 |
|
|
4927 |
TAGActcgagCTACTCGGTGACAAATTCAGAACTCTGTA |
|
|
RDC1 |
4928 |
GCGCaagcttATGGATGTGCACTTGTTTGACTAT |
1109 |
|
|
4929 |
TAGActcgagTCACTTGGTGTTCTGTTCCAGGGCA |
|
|
TPRA40 |
4930 |
GCGCaagcttATGGCCAGCCTGCAGGAG |
1130 |
|
|
4931 |
TAGActcgagTCAGGCATTGATGGCTTTCCAGCGC |
|
|
AGTRL1 |
4932 |
GCGCaagcttATGGAAGATGATGGTTACAA |
1156 |
|
|
4933 |
TAGActcgagCTAGTCCACAAGGGTTTCT |
|
|
GPR151 |
4934 |
GCGCaagcttATGGGAAAGGCAATGCTGAG |
1289 |
|
|
4935 |
TAGActcgagTCAAGTCTGTTAATTGCAGCCCTCTGTC |
|
Tabel 9: primers voor ‘full length directional cloning’ en de verwachte lengte van het amplicon
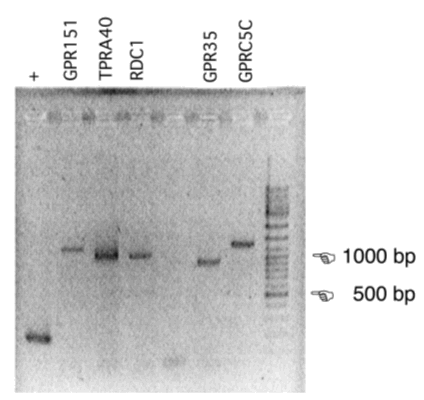
Fig. 5: Resultaten van PCR met de primers uit tabel 9 op cDNA van het muizendarmepitheel: volledige coderende lengte, geflankeerd door unieke restrictiesites
Als we alle GPCRs die hier worden aangetoond in een expressievector willen brengen moeten nog 16 primerparen van dit type ontworpen worden. De sequentie van het PCR product is noodzakelijk om zeker te zijn over de identiteit van het gen.
Aan het laboratorium van Prof. Shirazi-Beechey in Liverpool zijn de laatste jaren bewijzen verzameld voor glucose-sensing door een GPCR in het darmepitheel van schapen en muizen. Activatie van deze receptor verhoogt het aantal SGLT1 Na+-glucosetransporters in het apicale membraan, gemedieerd door de cAMP-PKA signaalweg. SGLT1 medieert secundair actief transport en kan glucose tegen een hoge gradiënt in transporteren. De receptor die het cAMP-signaal activeert moet dus een hoge affiniteit hebben voor glucose, zodat de expressie van SGLT1 door lage glucoseconcentraties wordt geďnduceerd. Daarnaast is er een mechanisme dat hoge glucose-concentraties detecteert en via PKC passief glucosetransport induceert. Hoewel hoge glucoseconcentraties intracellulair kunnen gesignaleerd worden dankzij de activiteit van SGLT1, is het mogelijk dat een GPCR met lage affiniteit voor glucose de Ca2+-PKC signaalweg activeert.
Het objectief van dit thesisonderzoek is om de aanwezigheid van zoveel mogelijk GPCR-genen aan te tonen in het cDNA dat aangemaakt werd door omgekeerde transcriptie van RNA-extracten van het muizendarmepitheel en STC-1 celculturen, met een voorkeur voor receptoren waarvan het ligand nog niet gekend is. De gebruikte technieken zijn op omgekeerde transcriptie en PCR gebaseerd. We tonen de aanwezigheid aan van mRNA’s, waaruit we kunnen besluiten welke genen tot transcriptie komen. We kunnen echter geen uitspraken doen over de localisatie in het membraan of de activiteit van het genproduct.
De eerste techniek die we hebben aangewend was DOP-PCR. Deze techniek is gebaseerd op sequentiehomologieën tussen de membraandomeinen van verschillende GPCR’s. Deze techniek is in het bijzonder geschikt om nieuwe genen te ontdekken in een organisme waarvan het genoom niet gekend is, op basis van de homologie met gekende genen. De onderzoeksgroepen die aan de hand van DOP-PCR nieuwe genen voor GPCR’s ontdekt hebben, hadden een grote capaciteit om vele primers in eerste instantie te testen op genomisch DNA en daarna de expressie van de ontdekte genen te onderzoeken in verschillende weefsels. We zijn er niet in geslaagd om een PCR-product te cloneren dat codeert voor een GPCR. In een organisme waarin nog maar weinig genen zijn gekend is men op deze techniek aangewezen. Dankzij de genoomsequentiebepaling van de muis, kan men in het RNA van schapendarmepitheelcellen gericht naar het schapenhomoloog van het muisgen zoeken, door middel van gedegenereerde primers op basis van de sequentie-alignering van het mRNA van de mens, de muis en het rund.
Aangezien we niet weten met welke gekende GPCR’s de glucosereceptor verwant kan zijn, en omdat er al zoveel GPCR genen ontdekt zijn in de muis, hebben we meer kans op slagen als we de expressie van gekende receptoren nagaan aan de hand van PCR met specifieke primers. Weesreceptoren interesseren ons uiteraard het meest. Om alle primers te laten renderen onderzochten we eerst de expressie van GPCR’s die reeds in de darm aangetoond waren. (O’dowd et al., 1997; Vassilatis et al., 2003) Om zelf ook de expressie van GPCR’s aan te tonen werd het RNA aan micro-array analyse onderworpen, waarna we voor alle wees-GPCR’s die op de micro-array gedetecteerd werden specifieke primers ontworpen hebben.
De GPCR’s in muizendarmepitheelcellen.
16 van de 29 onderzochte GPCR-RNA’s zijn met PCR aangetoond in zowel de muizendarmepitheelcellen als in de STC-1 cellen: TPRA40, GPR35, GPRC5C, GPR151, RDC1, AGTRL1, PGR22, GPR43, GPR125, TM7SF2, TM7SF3, GPR48, GPR56, GPR19, GPR85 en GPR40. Zes receptoren werden niet gedetecteerd met PCR op cDNA van STC-1 cellen (5 mM glucose) maar wel met PCR op het muizendarm cDNA, hoewel ze door micro-array-analyse ook in de STC-1 cellen aangetoond zijn: GPR80, TM7SF1, GPR1, GPR39, GPR61 en GPR120. We hebben dus de expressie van 22 GPCR’s aangetoond in het muizendarmepitheel. Van drie receptoren konden we enkel de expressie aantonen in STC-1 cellen: TEM5 en GPR49. Behalve GPR43, GPR40 en AGTRL1 zijn dit allemaal GPCR’s waarvan het ligand nog niet gekend is.
GPR43 of FFA2R is een receptor voor korte-keten vrije vetzuren en is gekoppeld aan Gq-proteďne dat bij activatie Ca2+ doet vrijstellen in leukocyten. (Le Poul et al., 2003) Mogelijk speelt GPR43 in de darm een rol in de detectie van de korte-keten vrije vetzuren die door bacteriën worden vrijgesteld. Van een andere receptor voor korte-keten vrije vetzuren, GPR41, zijn nog geen gegevens over de expressie in darmepitheelcellen verzameld. GPR43 heeft een hogere affiniteit voor acetaat, terwijl GPR41 meer selectief is voor butyraat en isobutyraat.
GPR40 is de receptor voor middellange- en lange-keten vetzuren in de β-cellen van de pancreas. Activatie van deze receptor leidt tot amplificatie van glucose-geďnduceerde vrijstelling van insuline. (Itoh et al., 2003) Deze receptor interageert met verzadigde vetzuren met een koolstofketenlengte van 12 tot 16 en met onverzadigde vetzuren van 18 tot 20 koolstofatomen. De niet-veresterde vetzuren (NEFA) in het plasma zijn de belangrijkste vorm van lipidetransport voor het zoogdier. Ze worden onder hormonale controle uit het vetweefsel vrijgesteld. NEFA zijn volgens Shafrir en Raz (2003) voor de zoogdiercellen een even belangrijke brandstof als glucose, en de concentratie ervan is sterk verhoogd bij hyperinsulinemie. De relatie met diabetes is zo sterk, dat wordt voorgesteld om voortaan over diabetes lipidus te spreken, in plaats van diabetes mellitus.
GPR40, GPR43 en GPR41 zijn verwant met elkaar en met de galanine receptorfamilie. Galanine is een neuropeptide dat invloed heeft op de voedselopname. In bepaalde hersengebieden wordt de expressie van de galanine receptor GAL-R1 verhoogd bij deprivatie van glucose en vetzuren. De verhoogde gevoeligheid aan galanine brengt een hogere voedselopname teweeg. (Gorbatyuk en Hökfeld, 1998) GAL-R1 werd op de micro-array gedetecteerd in het STC-1 RNA, maar er zijn (nog) geen primers voor ontworpen. Bij mijn weten (www.ncbi.nlm.nih.gov/unigen) worden GPR40 en GPR43 in deze studie voor het eerst aangetoond in darmepitheelcellen. De weesreceptoren in het darmepitheel die familie zijn van de galanine receptor (en bij uitbreiding de hele ‘somatostatin/galanin/opioid receptor family’), wekken nieuwsgierigheid in een onderzoek naar nutriënt-geactiveerde GPCR’s. GPR19 en GPR120 vertonen sequentiegelijkenissen met GAL-R1. GPR151 is verwant met GAL-R2 en GAL-R3. GPR88 vertoont gedeeltelijke sequentiehomologie met opioid receptoren.
AGTRL1 of ‘angiotensin receptor like 1’ of APJ is een receptor voor het peptide apelin en komt in hoge mate tot expressie in cardiovasculaire weefsels. Activatie van deze receptor resulteert in een verlaagde bloeddruk (Ishida et al., 2004) Net als galanine is apeline een neuropeptide dat een rol speelt in de voedselopname. Apeline wordt door melkkliercellen in grote hoeveelheden in het colostrum gesecreteerd en zou de immuunrespons van de zogeling beďnvloeden. (Habata et al., 1999) Toedienen van apeline aan STC-1 cellen resulteerde in de secretie van cholecystokinine. (Wang et al., 2004) Wij hebben aangetoond dat de expressie van AGTRL1 tien maal hoger is in STC-1 cellen in een medium met 25 mM glucose ten opzichte van STC-1 cellen in een medium met 5 mM glucose. De hoge glucoseconcentratie maakt de darmepitheelcellen dus gevoeliger aan apeline, dat bij een zogend dier afkomstig is van de melkklier van de moeder.
Alle weesreceptoren waarvan we de expressie aangetoond hebben zijn in principe kandidaten voor de rol van glucose-sensor, maar voor sommige van de weesreceptoren hebben we in de literatuur en in de databanken meer aanwijzingen gevonden dan voor andere. Informatie over de weefsels waar het gen tot expressie komt, de homologie met andere receptoren en de regulatie van de expressie werden opgezocht op de site van het NCBI.
De expressie van GPRC5C of ‘retinoic acid inducible gene 3’ (RAIG3) is aangetoond in verschillende weefsels, onder andere de nier, de pancreas, de lever en bepaalde gebieden van de hersenen. (Robbins et al., 2000) Het is een weesreceptor van de metabotrobe glutamaat receptor familie, die slechts een kort N-terminaal domein heeft. Berent-Spillson et al. (2004) tonen aan dat de glucose-geďnduceerde celdood van neuronen teniet kan gedaan worden door inhibitors van de metabotrobe glutamaat receptor GPRC1C (mGluR3). Wij tonen aan dat de expressie van GPRC5C sterk verhoogd is in STC-1 cellen bij een hogere glucoseconcentratie.
GPR35 werd door O’Dowd et al. in 1997 aangetoond in de dunne darm van de rat. Horikawa et al. (2000) toonden aan dat het gen zich op chromosoom twee bevindt, in een 66 kb interval dat gekoppeld is aan insuline-onafhankelijke diabetes melitus. SNPs in GPR35 tonen echter geen verband met type 2 diabetes. GPR35, GPR18 en GPR80 zijn verwant met de purinerge receptoren.
RDC1 of ‘vasoactive intestinal peptide receptor 1’ (VIPR1) werd in 1991 zo genoemd, maar volgens Nagata et al. (1992) is dit niet de receptor voor het ‘vasoactive intestinal peptide’ en dus nog steeds een weesreceptor die nu meestal CMKOR1 (chemokine orphan receptor 1) genoemd word. Wij toonden aan dat de expressie van RDC1 in STC-1 cellen vermindert bij een hogere glucoseconcentratie.
Doordat glucose in de epitheelcellen van de proximale tubulus ook een stijging van SGLT1 transporters veroorzaakt via de cAMP-PKA signaalweg (Loflin en Lever, 2001) vermoeden we dat dezelfde receptor hiervoor verantwoordelijk is. TPRA40, GPRC5C, RDC1, AGTRL1, PGR22, GPR125, TM7SF1, TM7SF2, TM7SF3 (transmembrane 7 superfamily member 1, 2 en 3) en GPR56 komen ook in de nier tot expressie. Aangezien er nog geen GPCR’s voor suikers werden ontdekt in zoogdieren, buiten de smaakreceptoren is het gebrek aan homologie met een andere receptor ook een positief gegeven voor een mogelijke glucosereceptor. PGR22, TM7SF1, TM7SF2, TM7SF3 en TPRA40 vertonen geen of slechts weinig homologie met andere GPCR’s waarvan het ligand gekend is.
We toonden aan dat TPRA40 (Transmembrane domain Protein Regulated in Adipocytes, 40 kD) in hoge mate tot expressie komt in de epitheelcellen van de dunne darm van een muis. Deze receptor werd eerder al aangetoond in adipocyten, hartweefsel, lever, nieren, pancreas, hersenen en longen. (Yang et al., 1999). Deze onderzoekers stelden vast dat de expressie van TPRA40 verhoogd is in adipocyten van diabetische muizen. Of dit het gevolg is of de oorzaak van glucose-intolerantie blijft een open vraag. Bij mijn weten wordt de expressie van deze receptor in de darmepitheelcellen door ons voor het eerst aangetoond. Hoewel er geen directe aanwijzing is dat dit de receptor voor glucose is, kan het nuttig zijn om na te gaan of de expressie van TPRA40 in de darm ook gecorreleerd is met diabetes. Ook kan het interessant zijn om aan een diabetoloog de hypothese voor te leggen dat een receptor voor glucose in de adypocyten van diabetici sterker tot expressie komt en dat dit een effect heeft op de afgave van NEFA.
TM7SF1 komt tot expressie in de nier, het hartweefsel, de tong, de pancreas en de milt. De expressie van deze receptor is opgereguleerd tijdens de ontwikkeling van de nier en blijft hoog in het ontwikkelde nierweefsel. (Spangenberg et al., 1998) Als dit zou inhouden dat het nierepitheel geen glucose transporteert als deze receptor nog niet aanwezig is, dan is TM7SF1 een zeer goede kandidaat voor onze glucosereceptor. Andere gegevens over deze receptor waren echter niet te vinden in de literatuur. De micro-array gegevens toonden aan dat de expressie van TM7SF1 in STC-1 cellen verminderd is bij 25 mM glucose ten opzicht van 5 mM glucose. We hebben deze receptor niet in de STC-1 cellen kunnen aantonen met RT-PCR gevolgd door agarosegelelectroforese, maar het mRNA werd wel op de micro-array gedetecteerd.
Een groot deel van de hier besproken resultaten berust enkel op de detectie op een micro-array en/of de aanwezigheid en de lengte van een bandje op een agarosegel. Voor de meeste receptor-mRNA’s zijn nog geen primerparen ontworpen die het volledige coderende gebied omvatten. Enerzijds is dit nodig om door sequentiebepaling zekerheid te verkrijgen over de identiteit van het PCR product, anderzijds moet ook een expressievector geconstrueerd worden voor de verdere stappen van dit onderzoek.
De vergelijking van het transcriptoom van STC-1 cellen bij verschillende glucoseconcentraties.
We hebben het RNA van verschillende STC-1 celculturen met elkaar vergeleken. Eén cultuur bevatte 5 mM glucose, de andere 25 mM glucose.
We hebben, net als Vayro et al. (2001) aangetoond dat de abundantie van het SGLT1-mRNA ongeveer verdubbeld is bij 25 mM glucose ten opzichte van 5 mM glucose, aan de hand van Q-PCR met actine als referentiegen. De expressie van GAPDH was ongeveer drie maal hoger. Dezelfde vergelijking bij de micro-array resultaten bevestigde deze waarneming.
We hebben ook de expressie van de verschillende receptoren vergeleken bij de verschillende glucoseconcentraties. De expressie van de glucosereceptor zou kunnen verminderd worden door de aanwezigheid van zijn ligand. Het Q-PCR experiment toonde aan dat RDC1 bij 25 mM glucose verminderd tot expressie komt. De micro-array toonde dit aan voor TM7SF1, GPR48, GPR49 en GPR20. De resultaten van Q-PCR toonden voor de meeste receptoren een verhoging aan bij de hogere glucoseconcentratie. Deze stijging was procentueel het hoogst voor AGTRL1, GPRC5C, GPR35 en GPR151, maar in absolute hoeveelheden steeg TPRA40 het meest. Deze laatste kwam veel sterker tot expressie dan de andere receptoren. Ook de vergelijking van de micro-array resultaten toonde een verhoogde expressie aan voor vier receptoren: TM7SF2, TM7SF3, GPR85 en GPR120.
Aangezien desensitisatie waarschijnlijk een post-transcriptioneel proces is en het niet eens zeker is dat er desensitisatie optreedt, is het niet absoluut vereist dat de mRNA concentratie van een glucosereceptor afneemt bij hogere glucoseconcentratie. Bovendien zou een receptor voor hoge glucoseconcentratie (die de passieve component van het glucosetransport zou activeren) hoger tot expressie kunnen komen bij 25 mM glucose. Omgekeerd is het wel zo dat een receptor die veel sterker tot expressie komt bij 25 mM glucose, waarschijnlijk niet de receptor is voor lage glucoseconcentraties (die het actief glucosetransport activeert).
Om de hoeveelheid cDNA in nanogram uit te kunnen drukken werd een ijkrechte opgesteld met verdunningen van genomisch DNA. De absolute hoeveelheid (C0) komt overeen met de hoeveelheid (in ng) genomisch DNA dat hetzelfde signaal geeft. Deze waarde werd dan genormaliseerd ten opzichte van actine. De cDNA concentratie is echter ook niet gelijk te stellen aan de mRNA concentratie, de efficientie van ‘reverse’ transcriptie verschilt tussen mRNA’s. Van sommige genen komt het reverse transcriptase niet tot bij het 5’ uiteinde van het mRNA. Doordat we Q-PCR primers ontwierpen op basis van het 3’ uiteinde van het mRNA (of het 5’ uiteinde van het cDNA, dicht bij de oligo(dT)-primer) minimaliseren we dit effect. De cDNA concentratie is niet exact gelijk te stellen aan de RNA concentratie, maar geeft wel een behoorlijk juist idee over welk genen sterker tot expressie komen dan andere.
Ons onderzoek heeft een duidelijker beeld gecreëerd van de receptoren die in de darmepitheelcellen tot expressie komen en heeft verschillende receptoren geďdentificeerd die goede kandidaten zijn voor de glucosereceptor.
Toekomstperspectief
Het is duidelijk dat nog heel wat onderzoek moet gebeuren om uit te maken welke van deze receptoren de receptor voor glucose zou kunnen zijn. Bovendien is het PCR-gebaseerde gedeelte van het onderzoek nog niet afgerond. In de eerste plaats moeten de resultaten die hier werden voorgesteld, bevestigd worden door sequentiebepaling. Ook moet het Q-PCR experiment afgewerkt worden voor 20 receptoren met het RNA van de twee STC-1 celculturen. Hiervoor zijn de primers al aanwezig en moeten er enkel nieuwe RNA-stalen opgestuurd worden vanuit Liverpool. Het kan ook heel nuttig zijn om Q-PCR uit te voeren met dezelfde primers na RT-reactie op RNA-extracten uit epitheelcellen van de verschillende gedeelten van de dunne darm en zo te bepalen welke receptor in welk gedeelte van de darm tot expressie komt.
De volgende stap in het onderzoek is functionele screening van de receptoren. Men kan met behulp van antilichamen bepalen in welk deel van het membraan van de epitheelcellen de GPCR’s zich bevinden, de receptor voor glucose moet in het borstelzoommembraan gelocaliseerd zijn. Als de expressie van één van deze receptoren het groeidefect in de gpr1Δ sch9Δ giststam kan teniet doen, is dit een sterke aanwijzing dat de receptor door glucose geactiveerd wordt. Anderzijds kan men de expressie van de receptoren proberen uit te schakelen in dierlijke cellen aan de hand van RNAi en nagaan of dit de glucose-geďnduceerde stijging van SGLT1-transporters verstoort.
Ook de receptoren met een gekend ligand die in de darm tot expressie komen kunnen nog verder onderzocht worden. Hebben GPR43 en GPR40 een functie als nutriëntsensor in de darm? (Komt GPR41 hier ook tot expressie?) Wat is de fysiologische rol van de verhoogde expressie van de receptor voor apeline AGTRL1 bij hogere glucoseconcentraties?
De epitheelcellen van de dunne darm moeten de aanwezigheid van glucose in het darmlumen kunnen detecteren. Het is aangetoond dat de extracellulaire detectie van glucose een verhoging van het aantal SGLT1 natrium/glucose cotransporters in het apicale membraan veroorzaakt en dat het glucose-signaal door de cAMP-PKA signaalweg gemedieerd wordt. Hetzelfde effect werd waargenomen in de entero-endocriene STC-1 cellijn, een beproefd in vitro modelsysteem voor darmepitheelcellen. Een lage concentratie aan glucose wordt waarschijnlijk door een G-proteďne gekoppelde receptor (GPCR) waargenomen die aan een G-proteďne gekoppeld is dat adenylaat cyclase activeert. (Dyer et al., 2003) Doordat het transport bij een hoge glucoseconcentratie, naast de actieve component die door SGLT1 gemedieerd wordt, ook uit een passieve component bestaat, zou er een tweede glucose-detectiemechanisme kunnen zijn, mogelijks een GPCR-systeem dat een Ca2+-signaal genereert.
Als startmateriaal hadden we RNA dat uit muizendarmepitheelcellen werd geďsoleerd en RNA dat uit twee STC-1 celculturen werd geďsoleerd die op verschillende glucoseconcentraties gegroeid zijn. We pasten omgekeerde transcriptie toe en PCR om mRNA’s te identificeren die voor een GPCR coderen en aanwezig zijn in de darmepitheelcellen. Om van nog meer GPCRs de expressie te achterhalen werd een micro-array experiment uitgevoerd, waarna we primers ontworpen hebben voor alle weesreceptoren die met het micro-array experiment gedetecteerd werden in minstens één van de twee STC-1 celculturen. In totaal hebben we 29 paren van specifieke primers gebruikt om GPCR-mRNA’s te identificeren aan de hand van de lengte van het amplicon na PCR op cDNA. Voor 7 GPCR’s en voor SGLT1 zijn quantitatieve PCR experimenten gedaan om de transcriptie in de twee STC-1 celculturen te vergelijken.
Aan de hand van micro-array analyse en PCR hebben de expressie van 22 GPCR’s aangetoond in de muizendarmepitheelcellen en in de STC-1 cellen: GPR43, GPR40, AGTRL1, TPRA40, TM7SF1, GPRC5C, GPR35, GPR151, RDC1, GPR125, GPR80, TM7SF2, TM7SF3, GPR48, GPR1, GPR56, GPR19, GPR85, GPR39, GPR61, GPR120 en GPR49.
GPR43 (FFA2R) is een receptor voor korte-keten vrije vetzuren en GPR40 is een receptor voor niet-veresterde vetzuren, beiden zijn nutriënten voor zoogdieren. Heeft de activatie van deze receptoren gevolgen voor het transport van hun liganden? Het aantonen van de expressie van deze receptoren in de dunne darm kan leiden tot de ontdekking van een nieuw ‘nutrient-sensing’ mechanisme.
AGTRL1 (APJ) is de receptor voor apeline, een neuropeptide dat betrokken is bij de voedselopname. Activatie van deze receptor leidt tot de secretie van cholecystokinine. Wij hebben aangetoond dat deze receptor tien keer hoger tot expressie komt in een STC-1 celcultuur met 25 mM glucose, ten opzichte van een celcultuur met 5 mM glucose.
Alle andere GPCR’s waarvan we de expressie in de muizendarmepitheelcellen hebben aangetoond zijn weesreceptoren. Voor enkele van deze receptors was in de literatuur een verband met glucose te vinden: TM7SF1 wordt opgereguleerd gedurende de ontwikkeling van de nier en de expressie van TPRA40 is verhoogd in het vetweefsel van diabetische muizen en komt ook in de nier tot expressie. Als er zich tussen deze weesreceptoren een receptor voor glucose bevindt, kan deze geďdentificeerd worden door functionele screening.
It is essential for epithelial cells of the small intestine to detect the presence of glucose in the lumen. It has been shown that the amount of the sodium/glucose cotransporter SGLT1 in the apical membrane of intestinal epithelial cells increases upon extracellular detection of glucose, and that the glucose signal is mediated by the cAMP-PKA pathway. The same effect has been shown in STC-1 cells, an entero-endocrine cell line that serves as an in vitro model for intestinal epithelial cells. Low concentrations of glucose are probably sensed by a GPCR coupled to a G-protein that activates adenylyl cyclase. (Dyer et al., 2003) Transport at high glucose-concentrations also has a passive component besides the active component mediated by SGLT1, so there might be a second glucose-sensing mechanism for high glucose concentrations, possibly a GPCR-system that generates a Ca2+-signal.
As starting material we have used RNA extracted from mouse intestinal epithelial cells and RNA extracted from two STC-1 cell cultures, which were grown with different concentrations of glucose. We have used reverse transcription and PCR to identify mRNAs encoding GPCRs, which are present in epithelial cells of the small intestine of mice. The receptor for glucose might be one of the many orphan GPCRs that have been discovered in the last decade. We have designed specific primers for GPCR genes that have been described to be expressed in the intestine. To identify the expression of more GPCRs we have performed a micro-array experiment and designed primers for all orphan GPCRs that were shown to be expressed in the STC-1 cell line. In total we have designed 29 specific primer pairs to identify GPCR-mRNAs by the length of the amplified sequence after PCR on cDNA. For 7 GPCRs and for SGLT1 we have done quantitative PCR experiments to compare transcription in the two STC-1 cultures.
Through micro-array-analysis and PCR we have shown the expression of 22 GPCR genes in mouse epithelial cells and STC-1 cells: GPR43, GPR40, AGTRL1, TPRA40, TM7SF1, GPRC5C, GPR35, GPR151, RDC1, GPR125, GPR80, TM7SF2, TM7SF3, GPR48, GPR1, GPR56, GPR19, GPR85, GPR39, GPR61, GPR120 and GPR49.
GPR43 (FFA2R) is a receptor for short chain fatty acids and GPR40 is a receptor for non esterified fatty acids, both of which are nutrients in mammals. Does activation of these receptors increase the rate of transport of the nutrients? The detection of these receptors in the small intestine might lead to the discovery of a novel nutrient sensing mechanism.
AGTRL1 (APJ) is the receptor for apelin, a neuropeptide involved in food intake. Binding of apelin to its receptor results in cholecystokinin secretion. We have shown that expression of this receptor in STC-1 cells is ten times higher at 25 mM glucose, compared to 5 mM glucose.
All the other GPRCs of which we demonstrated the expression in murine intestinal epithelial cells are orphan GPCRs. Only for a few could we find some clues in the literature that link the orphan GPCR to glucose: TM7SF1 is upregulated during kidney development. TPRA40 is increased in diabetic adipose tissue and is also expressed in kidney. If there is a receptor for glucose among these orphan GPCRs, it might be identified in functional screening experiments.
Barrenetxe J., Sainz N., Barber A., Lostao M.P. (2004).
Involvement of PKC and PKA in the inhibitory effect of leptin on intestinal galactose absorption.
Biochem. Biophys. Res. Commun., 317, 717-721.
Benson R.S., Sidhu S., Jones M.N., Case R.M., Thompson D.G. (2002).
Fatty acid signalling in a mouse enteroendocrine cell line involves fatty acid aggregates rather than free fatty acids.
J. Physiol., 538, 121-131.
Berent-Spillson A., Robinson A.M., Golovoy D., Slusher B., Rojas C., Russell J.W. (2004).
Protection against glucose-induced neuronal death by NAAG and GCP II inhibition is regulated by mGluR3.
J. Neurochem., 89, 90-99.
Berridge M.J. (1991).
Cytoplasmic calcium oscillations: a two pool model.
Cell Calcium., 12, 63-72.
Beullens M., Mbonyi K., Geerts L., Gladines D., Detremerie K., Jans A.W., Thevelein J.M. (1988).
Studies on the mechanism of the glucose-induced cAMP signal in glycolysis and glucose repression mutants of the yeast Saccharomyces cerevisiae.
Eur. J. Biochem., 172, 227-231.
Bockaert J., Pin J.P. (1999).
Molecular tinkering of G protein-coupled receptors: an evolutionary success.
EMBO J., 18, 1723-1729.
Boles E., Lehnert W., Zimmermann F.K. (1993).
The role of the NAD-dependent glutamate dehydrogenase in restoring growth on glucose of a Saccharomyces cerevisiae phosphoglucose isomerase mutant.
Eur. J. Biochem., 217, 469-477.
Borowsky B, Adham N, Jones KA, Raddatz R, Artymyshyn R, Ogozalek KL, Durkin MM, Lakhlani PP, Bonini JA, Pathirana S, Boyle N, Pu X, Kouranova E, Lichtblau H, Ochoa FY, Branchek TA, Gerald C. (2001)
Trace amines: identification of a family of mammalian G protein-coupled receptors.
Proc Natl Acad Sci U S A., 98(16), 8966-8971.
Buck L., Axel R. (1991).
A novel multigene family may encode odorant receptors: a molecular basis for odor recognition.
Cell., 65, 175-187.
Debnam E.S., Levin R.J. (1975).
An experimental method of identifying and quantifying the active transfer electrogenic component from the diffusive component during sugar absorption measured in vivo.
J. Physiol., 246, 181-196.
De Winde J.H., Crauwels M., Hohmann S., Thevelein J.M., Winderickx J. (1996).
Differential requirement of the yeast sugar kinases for sugar sensing in establishing the catabolite-repressed state.
Eur. J. Biochem., 241, 633-643.
Dyer J., Vayro S., Shirazi-Beechey S.P. (2003).
Mechanism of glucose sensing in the small intestine.
Biochem. Soc. Trans., 31, 140-142.
Fan X.C., Steitz J.A. (1998).
HNS, a nuclear-cytoplasmic shuttling sequence in HuR.
Proc. Natl. Acad. Sci. U S A., 95, 15293-15298.
Farrens D.L., Altenbach C., Yang K., Hubbell W.L., Khorana H.G. (1996).
Requirement of rigid-body motion of transmembrane helices for light activation of rhodopsin.
Science, 274, 768-770.
Gagiano M., Bauer F.F., Pretorius I.S. (2002).
The sensing of nutritional status and the relationship to filamentous growth in Saccharomyces cerevisiae.
FEMS Yeast Res., 2, 433-470.
Gorbatyuk O., Hokfelt T. (1998).
Effects of antimetabolites to glucose and fatty acids on galanin-1 receptor mRNA levels in the hypothalamic paraventricular and supraoptic nuclei.
Ann N.Y. Acad. Sci., 863, 430-431.
Graul R.C., Sadee W. (2001).
Evolutionary relationships among G protein-coupled receptors using a clustered database approach.
AAPS Pharm. Sci., 3, E12.
Habata Y., Fujii R., Hosoya M., Fukusumi S., Kawamata Y., Hinuma S., Kitada C., Nishizawa N., Murosaki S., Kurokawa T., Onda H., Tatemoto K., Fujino M. (1999).
Apelin, the natural ligand of the orphan receptor APJ, is abundantly secreted in the colostrum.
Biochim. Biophys. Acta., 1452, 25-35.
Helliwell P.A., Rumsby M.G., Kellett G.L. (2003).
Intestinal sugar absorption is regulated by phosphorylation and turnover of protein kinase C betaII mediated by phosphatidylinositol 3-kinase- and mammalian target of rapamycin-dependent pathways.
J. Biol. Chem., 278, 28644-28650.
Herrero P., Martinez-Campa C., Moreno F. (1998).
The hexokinase 2 protein participates in regulatory DNA-protein complexes necessary for glucose repression of the SUC2 gene in Saccharomyces cerevisiae.
FEBS Lett., 434, 71-76.
Hohmann S., Winderickx J., de Winde J.H., Valckx D., Cobbaert P., Luyten K., de Meirsman C., Ramos J., Thevelein J.M. (1999).
Novel alleles of yeast hexokinase PII with distinct effects on catalytic activity and catabolite repression of SUC2.
Microbiology, 145, 703-714.
Horikawa Y., Oda N., Cox N.J.; Li X., Orho-Melander M., Hara M., Hinokio Y., Lindner T.H., Mashima H., Schwarz P.E.H., del Bosque-Plata L., Horikawa Y. (2000).
Genetic variation in the gene encoding calpain-10 is associated with type 2 diabetes mellitus.
Nature Genet., 26, 163-175.
Ishida J., Hashimoto T., Hashimoto Y., Nishiwaki S., Iguchi T., Harada S., Sugaya T., Matsuzaki H., Yamamoto R., Shiota N., Okunishi H., Kihara M., Umemura S., Sugiyama F., Yagami K.I., Kasuya Y., Mochizuki N., Fukamizu A. (2004).
Regulatory roles for APJ, a seven-transmembrane receptor related to AT1, in blood pressure in vivo.
J. Biol. Chem. [Epub ahead of print]
Itoh Y., Kawamata Y., Harada M., Kobayashi M., Fujii R., Fukusumi S., Ogi K., Hosoya M., Tanaka Y., Uejima H., Tanaka H., Maruyama M., Satoh R., Okubo S., Kizawa H., Komatsu H., Matsumura F., Noguchi Y., Shinohara T., Hinuma S., Fujisawa Y., Fujino M. (2003).
Free fatty acids regulate insulin secretion from pancreatic beta cells through GPR40
Nature, 422, 173-176.
Jang JC, Sheen J. (1994)
Sugar sensing in higher plants.
Plant Cell., 6(11):1665-1679.
Kellett GL. (2001)
The facilitated component of intestinal glucose absorption.
J Physiol, 531, 585-595.
Kellett GL, Helliwell PA. (2000)
The diffusive component of intestinal glucose absorption is mediated by the glucose-induced recruitment of GLUT2 to the brush-border membrane.
Biochem J., 350,155-162.
Kipp, H., S. Khoursandi, D. Scharlau and R.K.H. Kinne (2003)
More than apical: distribution of SGLT1 in Caco-2 cells
American Journal of Physiology-Cell Physiology 285, C737-C749.
Kraakman L, Lemaire K, Ma P, Teunissen AW, Donaton MC, Van Dijck P, Winderickx J, de Winde JH, Thevelein JM. (1999)
A Saccharomyces cerevisiae G-protein coupled receptor, Gpr1, is specifically required for glucose activation of the cAMP pathway during the transition to growth on glucose.
Mol Microbiol. 32, 1002-1012.
Lafuente MJ, Gancedo C, Jauniaux JC, Gancedo JM. (2000)
Mth1 receives the signal given by the glucose sensors Snf3 and Rgt2 in Saccharomyces cerevisiae.
Mol Microbiol., 35, 161-172.
Lemaire K.
Gpr1, a G-protein coupled receptor involved in glucose-sensing in Saccharomyces cerevisiae
doctoraatsverhandeling
Le Poul E, Loison C, Struyf S, Springael JY, Lannoy V, Decobecq ME, Brezillon S, Dupriez V, Vassart G, Van Damme J, Parmentier M, Detheux M. (2003)
Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation.
J Biol Chem., 278, 25481-9. Epub 2003 Apr 23.
Libert F, Parmentier M, Lefort A, Dinsart C, Van Sande J, Maenhaut C, Simons MJ, Dumont JE, Vassart G. (1989)
Selective amplification and cloning of four new members of the G protein-coupled receptor family.
Science., 244, 569-72.
Liu M, Parker RM, Darby K, Eyre HJ, Copeland NG, Crawford J, Gilbert DJ, Sutherland GR, Jenkins NA, Herzog H. (1999)
GPR56, a novel secretin-like human G-protein-coupled receptor gene.
Genomics., 55, 296-305.
Loflin P, Lever JE. (2001)
HuR binds a cyclic nucleotide-dependent, stabilizing domain in the 3' untranslated region of Na(+)/glucose cotransporter (SGLT1) mRNA.
FEBS Lett., 509, 267-71.
Lu JY, Schneider RJ. (2004)
Tissue distribution of AU-rich mRNA-binding proteins involved in regulation of mRNA decay.
J Biol Chem., 279, 12974-9. Epub 2004 Jan 07.
Marchese A, Nguyen T, Malik P, Xu S, Cheng R, Xie Z, Heng HH, George SR, Kolakowski LF Jr, O'Dowd BF. (1998)
Cloning genes encoding receptors related to chemoattractant receptors.
Genomics., 50, 281-6.
Nagata S, Ishihara T, Robberecht P, Libert F, Parmentier M, Christophe J, Vassart G. (1992)
RDC1 may not be VIP receptor.
Trends Pharmacol Sci., 13, 102-3.
O'Dowd BF, Nguyen T, Lynch KR, Kolakowski LF Jr, Thompson M, Cheng R, Marchese A, Ng G, Heng HH, George SR. (1996)
A novel gene codes for a putative G protein-coupled receptor with an abundant expression in brain.
FEBS Lett., 394, 325-9.
O'Dowd BF, Nguyen T, Jung BP, Marchese A, Cheng R, Heng HH, Kolakowski LF Jr, Lynch KR, George SR. (1997)
Cloning and chromosomal mapping of four putative novel human G-protein-coupled receptor genes.
Gene., 187, 75-81.
Ozcan S, Dover J, Rosenwald AG, Wolfl S, Johnston M. (1996)
Two glucose transporters in Saccharomyces cerevisiae are glucose sensors that generate a signal for induction of gene expression.
Proc Natl Acad Sci U S A., 93, 12428-32.
Ozcan S, Johnston M. (1995)
Three different regulatory mechanisms enable yeast hexose transporter (HXT) genes to be induced by different levels of glucose.
Mol Cell Biol., 15, 1564-72.
Pappenheimer JR, Reiss KZ. (1987)
Contribution of solvent drag through intercellular junctions to absorption of nutrients by the small intestine of the rat.
J Membr Biol., 100, 123-36.
Pego JV, Weisbeek PJ, Smeekens SC. (1999)
Mannose inhibits Arabidopsis germination via a hexokinase-mediated step.
Plant Physiol., 119, 1017-23.
Pernambuco MB, Winderickx J, Crauwels M, Griffioen G, Mager WH, Thevelein JM. (1996)
Glucose-triggered signalling in Saccharomyces cerevisiae: different requirements for sugar phosphorylation between cells grown on glucose and those grown on non-fermentable carbon sources.
Microbiology., 142, 1775-82.
Schuit FC, Huypens P, Heimberg H, Pipeleers DG. (2001)
Glucose sensing in pancreatic beta-cells: a model for the study of other glucose-regulated cells in gut, pancreas, and hypothalamus.
Diabetes. 50, 1-11.
Robbins MJ, Michalovich D, Hill J, Calver AR, Medhurst AD, Gloger I, Sims M, Middlemiss DN, Pangalos MN. (2000)
Molecular cloning and characterization of two novel retinoic acid-inducible orphan G-protein-coupled receptors (GPRC5B and GPRC5C).
Genomics, 67, 8-18.
Rolland F, De Winde JH, Lemaire K, Boles E, Thevelein JM, Winderickx J. (2000)
Glucose-induced cAMP signalling in yeast requires both a G-protein coupled receptor system for extracellular glucose detection and a separable hexose kinase-dependent sensing process.
Mol Microbiol., 38, 348-58.
Rolland F, Wanke V, Cauwenberg L, Ma P, Boles E, Vanoni M, de Winde JH, Thevelein JM, Winderickx J. (2001)
The role of hexose transport and phosphorylation in cAMP signalling in the yeast Saccharomyces cerevisiae.
FEMS Yeast Res., 1,33-45.
Rolland F, Winderickx J, Thevelein JM. (2002)
Glucose-sensing and -signalling mechanisms in yeast.
FEMS Yeast Res., 2, 183-201.
Schmidt MC, McCartney RR, Zhang X, Tillman TS, Solimeo H, Wolfl S, Almonte C, Watkins SC. (1999)
Std1 and Mth1 proteins interact with the glucose sensors to control glucose-regulated gene expression in Saccharomyces cerevisiae.
Mol Cell Biol., 19, 4561-71.
Shafrir E, Raz I. (2003)
Diabetes: mellitus or lipidus?
Diabetologia. 46, 433-40.
Shirazi-Beechey SP, Hirayama BA, Wang Y, Scott D, Smith MW, Wright EM. (1991)
Ontogenic development of lamb intestinal sodium-glucose co-transporter is regulated by diet.
J Physiol., 437, 699-708.
Shyng SL, Ferrigni T, Shepard JB, Nestorowicz A, Glaser B, Permutt MA, Nichols CG. (1998)
Functional analyses of novel mutations in the sulfonylurea receptor 1 associated with persistent hyperinsulinemic hypoglycemia of infancy.
Diabetes. 47, 1145-51.
Spangenberg C, Winterpacht A, Zabel BU, Lobbert RW. (1998)
Cloning and characterization of a novel gene (TM7SF1) encoding a putative seven-pass transmembrane protein that is upregulated during kidney development.
Genomics., 48, 178-85.
Stumpel F, Burcelin R, Jungermann K, Thorens B. (2001)
Normal kinetics of intestinal glucose absorption in the absence of GLUT2: evidence for a transport pathway requiring glucose phosphorylation and transfer into the endoplasmic reticulum.
Proc Natl Acad Sci U S A., 98, 11330-5.
Takada Y, Kato C, Kondo S, Korenaga R, Ando J. (1997)
Cloning of cDNAs encoding G protein-coupled receptor expressed in human endothelial cells exposed to fluid shear stress.
Biochem Biophys Res Commun., 240, 737-41.
Tarpey PS, Wood IS, Shirazi-Beechey SP, Beechey RB. (1995)
Amino acid sequence and the cellular location of the Na(+)-dependent D-glucose symporters (SGLT1) in the ovine enterocyte and the parotid acinar cell.
Biochem J., 312, 293-300.
Tensen CP, Van Kesteren ER, Planta RJ, Cox KJ, Burke JF, van Heerikhuizen H, Vreugdenhil E. (1994)
A G protein-coupled receptor with low density lipoprotein-binding motifs suggests a role for lipoproteins in G-linked signal transduction.
Proc Natl Acad Sci U S A., 91, 4816-20.
Thevelein JM. (1991)
Fermentable sugars and intracellular acidification as specific activators of the RAS-adenylate cyclase signalling pathway in yeast: the relationship to nutrient-induced cell cycle control.
Mol Microbiol., 5, 1301-7.
Thevelein JM. (1994)
Signal transduction in yeast.
Yeast., 10, 1753-90.
Tobin AB. (1997)
Phosphorylation of phospholipase C-coupled receptors.
Pharmacol Ther., 75, 135-51.
Unger VM, Hargrave PA, Baldwin JM, Schertler GF. (1997)
Arrangement of rhodopsin transmembrane alpha-helices.
Nature., 389, 203-6.
Vassilatis DK, Hohmann JG, Zeng H, Li F, Ranchalis JE, Mortrud MT, Brown A, Rodriguez SS, Weller JR, Wright AC, Bergmann JE, Gaitanaris GA. (2003)
The G protein-coupled receptor repertoires of human and mouse.
Proc Natl Acad Sci U S A. 100, 4903-8.
Vernier P, Cardinaud B, Valdenaire O, Philippe H, Vincent JD. (1995)
An evolutionary view of drug-receptor interaction: the bioamine receptor family.
Trends Pharmacol Sci., 16, 375-81.
Versele M, Lemaire K, Thevelein JM. (2001)
Sex and sugar in yeast: two distinct GPCR systems.
EMBO Rep., 2, 574-9.
Veyhl M, Wagner CA, Gorboulev V, Schmitt BM, Lang F, Koepsell H. (2003)
Downregulation of the Na(+)- D-glucose cotransporter SGLT1 by protein RS1 (RSC1A1) is dependent on dynamin and protein kinase C.
J Membr Biol., 196, 71-81.
Walker JK, Gainetdinov RR, Feldman DS, McFawn PK, Caron MG, Lefkowitz RJ, Premont RT, Fisher JT. (2004)
G protein-coupled receptor kinase 5 regulates airway responses induced by muscarinic receptor activation.
Am J Physiol Lung Cell Mol Physiol., 286, L312-9. Epub 2003 Oct 17.
Wang G, Anini Y, Wei W, Qi X, OCarroll AM, Mochizuki T, Wang HQ, Hellmich MR, Englander EW, Greeley GH Jr.
Apelin, a new enteric peptide: localization in the gastrointestinal tract, ontogeny, and stimulation of gastric cell proliferation and of cholecystokinin secretion.
Endocrinology., 145, 1342-8.
Wilkie TM, Chen Y, Gilbert DJ, Moore KJ, Yu L, Simon MI, Copeland NG, Jenkins NA. (1993)
Identification, chromosomal location, and genome organization of mammalian G-protein-coupled receptors.
Genomics., 18, 175-84.
Wright EM, Hirsch JR, Loo DD, Zampighi GA. (1997)
Regulation of Na+/glucose cotransporters.
J Exp Biol., 200, 287-93.
Wright EM, Martin MG, Turk E. (2003)
Intestinal absorption in health and disease--sugars.
Best Pract Res Clin Gastroenterol., 17, 943-56.
Xue Y, Batlle M, Hirsch JP. (1998)
GPR1 encodes a putative G protein-coupled receptor that associates with the Gpa2p Galpha subunit and functions in a Ras-independent pathway.
EMBO J., 17, 1996-2007
Yang H, Egan JM, Rodgers BD, Bernier M, Montrose-Rafizadeh C. (1999)
Differential expression of a novel seven transmembrane domain protein in epididymal fat from aged and diabetic mice.
Endocrinology., 140, 2859-67.
Zhao Z, Chang FC, Furneaux HM. (2000)
The identification of an endonuclease that cleaves within an HuR binding site in mRNA.
Nucleic Acids Res., 28, 2695-701
| home | lijst scripties | inhoud | vorige | volgende |